题目内容
已知溶液中存在Cr2O72-+ H2O 2CrO42-+ 2H+的平衡,其中Cr2O72-呈橙色,CrO42-呈黄色,向该平衡体系中滴加饱和NaOH溶液时,颜色的变化情况是
2CrO42-+ 2H+的平衡,其中Cr2O72-呈橙色,CrO42-呈黄色,向该平衡体系中滴加饱和NaOH溶液时,颜色的变化情况是
 2CrO42-+ 2H+的平衡,其中Cr2O72-呈橙色,CrO42-呈黄色,向该平衡体系中滴加饱和NaOH溶液时,颜色的变化情况是
2CrO42-+ 2H+的平衡,其中Cr2O72-呈橙色,CrO42-呈黄色,向该平衡体系中滴加饱和NaOH溶液时,颜色的变化情况是| A.黄色加深 | B.橙色加深 | C.颜色不变 | D.颜色褪去 |
A
Cr2O72-+ H2O
 2CrO42-+ 2H+,向该平衡体系中滴加饱和NaOH溶液时,H+浓度减小,平衡正向移动,黄色加深,A正确。
2CrO42-+ 2H+,向该平衡体系中滴加饱和NaOH溶液时,H+浓度减小,平衡正向移动,黄色加深,A正确。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 R(g) + S(g)。下列说法中可以充分说明这一反应已经达到化学平衡的是
R(g) + S(g)。下列说法中可以充分说明这一反应已经达到化学平衡的是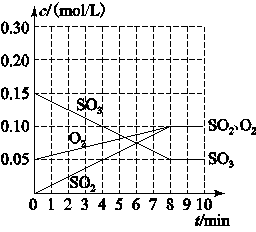
 z C(g),平衡时测得A的浓度为 0.5 mol/L,保持温度不变,将容器的容积压缩到原来的1/2,再达平衡时测得A的浓度为 0.8mol/L,下列判断正确的是( )
z C(g),平衡时测得A的浓度为 0.5 mol/L,保持温度不变,将容器的容积压缩到原来的1/2,再达平衡时测得A的浓度为 0.8mol/L,下列判断正确的是( ) 2C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。
2C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。
 N2O4(g) ΔH<0在密闭容器中达到平衡,下列叙述中正确的是 ( )
N2O4(g) ΔH<0在密闭容器中达到平衡,下列叙述中正确的是 ( ) SiF4(g)+ 2H2O(g) △H =-148.9 kJ·mo1-1
SiF4(g)+ 2H2O(g) △H =-148.9 kJ·mo1-1