题目内容
已知反应:下列结论正确的是( )
①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4.
①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4.
分析:本题根据氧化还原反应的本质为有电子的得失可以判断反应是否为氧化还原反应;氧化剂得电子、被还原、生成还原产物,还原剂失电子、被氧化、生成氧化产物;判断得失电子数;氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性等知识点.
解答:解:A.①化学反应方程式中没有电子的得失,不为氧化还原反应,故A错误;
B.在②反应中K2Cr2O7为氧化剂,FeSO4为还原剂,Fe2(SO4)3为氧化产物,Cr2(SO4)3为还原产物,在第三个反应中Fe2(SO4)3为氧化剂,HI为还原剂,I2为氧化产物,FeSO4为还原产物,氧化剂的氧化性大于氧化产物的还原性,故氧化性强弱顺序是:K2Cr2O7>Fe2(SO4)3>I2,故B正确;
C.反应②中K2Cr2O7为氧化剂,FeSO4为还原剂,物质的量之比为6:1,故C正确;
D.反应③中HI为还原剂,1 molHI被氧化失去1 mol电子,0.1mol还原剂共失去电子数为6.02×1022,故D错误;
故选BC.
B.在②反应中K2Cr2O7为氧化剂,FeSO4为还原剂,Fe2(SO4)3为氧化产物,Cr2(SO4)3为还原产物,在第三个反应中Fe2(SO4)3为氧化剂,HI为还原剂,I2为氧化产物,FeSO4为还原产物,氧化剂的氧化性大于氧化产物的还原性,故氧化性强弱顺序是:K2Cr2O7>Fe2(SO4)3>I2,故B正确;
C.反应②中K2Cr2O7为氧化剂,FeSO4为还原剂,物质的量之比为6:1,故C正确;
D.反应③中HI为还原剂,1 molHI被氧化失去1 mol电子,0.1mol还原剂共失去电子数为6.02×1022,故D错误;
故选BC.
点评:本题考查了氧化还原反应的本质、氧化剂、还原剂、氧化产物、还原产物、得失电子数,氧化剂的氧化性大于氧化产物的氧化性等知识点.

练习册系列答案
相关题目
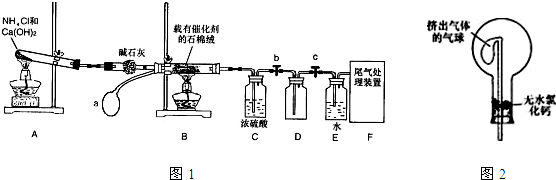
 (2013?闸北区二模)如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(2013?闸北区二模)如图是煤化工产业链的一部分,试运用所学知识,解决下列问题: