题目内容
10mL硫酸中加入3.2g氧化铁末,固体恰好全部溶解,再加入5g铁粉,反应过程中未见气体产生.
求:(1)硫酸的物质的量浓度;(2)反应后剩余铁粉多少g?
求:(1)硫酸的物质的量浓度;(2)反应后剩余铁粉多少g?
考点:化学方程式的有关计算
专题:计算题
分析:稀硫酸和氧化铁反应生成硫酸铁,固体恰好全部溶解,反应后溶液硫酸无剩余,向混合溶液中加入铁粉,铁和铁离子反应生成亚铁离子,反应过程中未见气体产生,进一步说明硫酸无剩余,
(1)根据Fe2O3+6H+=2Fe3++3H2O计算硫酸的物质的量,根据C=
计算硫酸的物质的量浓度;
(2)根据Fe+2Fe3+=3Fe2+计算反应后剩余铁粉.
(1)根据Fe2O3+6H+=2Fe3++3H2O计算硫酸的物质的量,根据C=
| n |
| v |
(2)根据Fe+2Fe3+=3Fe2+计算反应后剩余铁粉.
解答:
解:(1)3.2g氧化铁n(Fe2O3)=
=
=0.02mol,稀硫酸和氧化铁反应生成硫酸铁,固体恰好全部溶解,反应后溶液硫酸无剩余,
Fe2O3 +6H+=2Fe3++3H2O,
1mol 6mol 2mol
0.02mol 0.12mol 0.04mol
n(H2SO4)=
n(H+)=0.12mol×
=0.06mol,
c(H2SO4)=
=
=6mol/L,
答:硫酸的物质的量浓度为6mol/L;
(2)再加入5g铁粉,反应过程中未见气体产生,硫酸无剩余,发生Fe+2Fe3+=3Fe2+,
Fe+2Fe3+=3Fe2+
1mol 2mol
0.02mol 0.04mol
所以反应后剩余铁粉5g-0.02mol×56g/mol=3.88g,
答:反应后剩余铁粉3.88g.
| m |
| M |
| 3.2g |
| 160g/mol |
Fe2O3 +6H+=2Fe3++3H2O,
1mol 6mol 2mol
0.02mol 0.12mol 0.04mol
n(H2SO4)=
| 1 |
| 2 |
| 1 |
| 2 |
c(H2SO4)=
| n |
| v |
| 0.06mol |
| 0.01L |
答:硫酸的物质的量浓度为6mol/L;
(2)再加入5g铁粉,反应过程中未见气体产生,硫酸无剩余,发生Fe+2Fe3+=3Fe2+,
Fe+2Fe3+=3Fe2+
1mol 2mol
0.02mol 0.04mol
所以反应后剩余铁粉5g-0.02mol×56g/mol=3.88g,
答:反应后剩余铁粉3.88g.
点评:本题考查了有关铁及其化合物的计算,明确发生的反应是解本题关键,注意根据相关反应方程式进行计算,题目难度不大.

练习册系列答案
相关题目
下列有关说法正确的是( )
| A、晶体析出规则是晶格能高的晶体最后析出 |
| B、铜型和钾型都是密置层堆积方式 |
| C、邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点高 |
| D、在干冰晶体中,每一个CO2周围有12个紧邻的CO2分子 |
1 1 |
2 1 |
3 1 |
| A、氢的五种同位素 |
| B、五种氢元素 |
| C、氢的五种原子 |
| D、氢元素的五种不同微粒 |
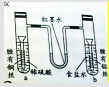 某同学为了探究金属腐蚀的原理,设计了如图装置,U型管内为红墨水,a、b试管内分别盛有稀硫酸和NaCl溶液,然后分别浸入末端缠有铜丝和铝丝的铁钉,放置一段时间,下列有关描述错误的是( )
某同学为了探究金属腐蚀的原理,设计了如图装置,U型管内为红墨水,a、b试管内分别盛有稀硫酸和NaCl溶液,然后分别浸入末端缠有铜丝和铝丝的铁钉,放置一段时间,下列有关描述错误的是( )| A、a、b中负极反应式均是:Fe-2e═Fe2+ |
| B、红墨水柱两边的液面变为左低右高 |
| C、a中铁钉上发生了氧化反应,b中铁钉上发生还原反应 |
| D、a中铜丝附近有气泡产生,b中有白色沉淀产生 |



