题目内容
下列叙述正确的是( )
| A、根据α 粒子散射现象,提出带核的原子结构模型的科学家是玻尔 |
| B、氯气是瑞典化学家舍勒首先发现的 |
| C、海水中含有丰富的碘元素,因此碘被称为“海洋元素” |
| D、溴化银具有感光性,可用于人工降雨 |
考点:氯、溴、碘及其化合物的综合应用
专题:卤族元素
分析:A、α 粒子散射现象是科学家卢瑟福;
B、18世纪70年代,瑞典化学家舍勒首先发现并制得了氯气(Cl2);
C、海洋元素为溴;
D、碘化银用于人工降雨.
B、18世纪70年代,瑞典化学家舍勒首先发现并制得了氯气(Cl2);
C、海洋元素为溴;
D、碘化银用于人工降雨.
解答:
解:A、α 粒子散射现象,提出带核的原子结构模型的科学家是科学家卢瑟福,故A错误;
B、18世纪70年代,瑞典化学家舍勒首先发现并制得了氯气(Cl2),故B正确;
C、海洋元素为溴,故C错误;
D、溴化银具有感光性,碘化银用于人工降雨,故D错误;
故选B.
B、18世纪70年代,瑞典化学家舍勒首先发现并制得了氯气(Cl2),故B正确;
C、海洋元素为溴,故C错误;
D、溴化银具有感光性,碘化银用于人工降雨,故D错误;
故选B.
点评:本题考查了物质性质的理解应用,主要是化学常识和物质性质的应用,题目较简单.

练习册系列答案
相关题目
设NA表示阿伏加德罗常数.下列说法中,不正确的是( )
| A、标准状况下,22.4 L氢气和氧气的混合气体,所含分子数为NA |
| B、物质的量浓度为0.5 mol?L-1的MgCl2溶液中,含有Cl-个数为 NA |
| C、常温常压下,1 mol氨气含有的原子数为4NA |
| D、1L含1 mol FeCl3溶液中Cl-的数目为3NA |
氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性.下列叙述中不正确( )
| A、红热的铜丝在氯气中剧烈燃烧,生成棕黄色烟 |
| B、钠在氯气中燃烧,生成白色的烟 |
| C、纯净的氢气在氯气中安静的燃烧,在集气瓶口形成白色烟雾 |
| D、氯气能与水反应生成盐酸和次氯酸,次氯酸见光易分解 |
某溶液既能溶解Al(OH)3,又能溶解BaCO3且均形成溶液,在该溶液中可以大量共存的离子组是( )
| A、Fe3+、Mg2+、SO42-、NO3- |
| B、Ag+、Al3+、NO3-、OH- |
| C、Na+、Ba2+,Cl-、ClO- |
| D、K+、Na+、CO32-、NO3- |

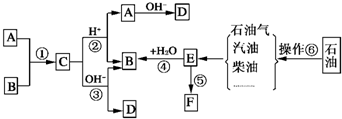 已知:A、B、F是家庭中常见的有机物,F常用于食品包装,E是石油化工发展水平的标志.根据下面转化关系回答问题.
已知:A、B、F是家庭中常见的有机物,F常用于食品包装,E是石油化工发展水平的标志.根据下面转化关系回答问题.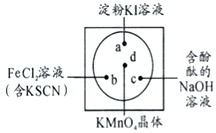 微型化学实验可以有效实现化学实验绿色化的要求.如下图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.
微型化学实验可以有效实现化学实验绿色化的要求.如下图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.