题目内容
在25℃时,用石墨电极电解2.0L 0.5mol?L-1 CuSO4溶液.5min后,在一个石墨电极上有6.4g Cu生成.试回答下列问题:
(1)发生氧化反应的是 极,电极反应式为 .
(2)若电解后溶液的体积不变,则电解后溶液的pH为 .
(3)若将溶液恢复到与电解前一样,则需加入 mol的 .
(4)若用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差 g,电解液的pH .(填“变小”、“变 大”或“不变”)
(1)发生氧化反应的是
(2)若电解后溶液的体积不变,则电解后溶液的pH为
(3)若将溶液恢复到与电解前一样,则需加入
(4)若用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差
考点:电解原理
专题:电化学专题
分析:在25℃时,用石墨电极电解2.0 L,0.5mol/LCuSO4溶液中Cu2+物质的量为0.5mol,5min后,在一个石墨电极上有6.4 g Cu生成物质的量为0.1mol;
(1)电解过程中,溶液中阴离子OH-、SO42-移向阳极,氢氧根离子放电发生氧化反应,电极反应式:4OH--4e-═2H2O+O2↑;
(2)依据电极反应电子守恒,生成铜物质的量为0.1mol,电子转移为0.2mol;
阳极反应为、4OH--4e-═2H2O+O2↑
0.2mol 0.2mol 0.05mol
阴极反应为、2Cu2++4e-═2Cu
0.1mol 0.2mol 0.1mol
所以电解过程中电子转移为0.2mol;
生成氧气的体积=0.05mol×22.4L/mol=1.12L;
溶液的PH的计算可以依据水电离出的氢离子和氢氧根离子守恒,减少氢氧根离子0.2mol,溶液中增加氢离子0.2mol,c(H+)=
=0.1mol/L;pH=-lgC(H+)=1;
(3)根据缺什么加什么,结合电解方程式计算出需要加入的物质及物质的量;
(4)如用等质量的两块铜片代替石墨作电极,是镀铜,阳极反应为:Cu-2e-=Cu2+;阴极电极反应为:Cu2++2e-=Cu;电子转移0.2mol,阳极减少质量为0.1mol×64g/mol=6.4g;同时阴极析出铜6.4g;电解后两铜片的质量相差12.8g,电解质溶液的pH不变.
(1)电解过程中,溶液中阴离子OH-、SO42-移向阳极,氢氧根离子放电发生氧化反应,电极反应式:4OH--4e-═2H2O+O2↑;
(2)依据电极反应电子守恒,生成铜物质的量为0.1mol,电子转移为0.2mol;
阳极反应为、4OH--4e-═2H2O+O2↑
0.2mol 0.2mol 0.05mol
阴极反应为、2Cu2++4e-═2Cu
0.1mol 0.2mol 0.1mol
所以电解过程中电子转移为0.2mol;
生成氧气的体积=0.05mol×22.4L/mol=1.12L;
溶液的PH的计算可以依据水电离出的氢离子和氢氧根离子守恒,减少氢氧根离子0.2mol,溶液中增加氢离子0.2mol,c(H+)=
| 0.2mol |
| 2L |
(3)根据缺什么加什么,结合电解方程式计算出需要加入的物质及物质的量;
(4)如用等质量的两块铜片代替石墨作电极,是镀铜,阳极反应为:Cu-2e-=Cu2+;阴极电极反应为:Cu2++2e-=Cu;电子转移0.2mol,阳极减少质量为0.1mol×64g/mol=6.4g;同时阴极析出铜6.4g;电解后两铜片的质量相差12.8g,电解质溶液的pH不变.
解答:
解:在25℃时,用石墨电极电解2.0 L,0.5mol/LCuSO4溶液中Cu2+物质的量为0.5mol,5min后,在一个石墨电极上有6.4 g Cu生成物质的量为0.1mol;
(1)电解过程中,溶液中阴离子OH-、SO42-移向阳极,氢氧根离子放电发生氧化反应,电极反应式:4OH--4e-═2H2O+O2↑,故答案为:阳;4OH--4e-═2H2O+O2↑;
(2)依据电极反应电子守恒,生成铜物质的量为0.1mol,电子转移为0.2mol;
阳极反应为4OH--4e-═2H2O+O2↑
0.2mol 0.2mol 0.05mol
阴极反应为2Cu2++4e-═2Cu
0.1mol 0.2mol 0.1mol
所以电解过程中电子转移为0.2mol;
生成氧气的体积=0.05mol×22.4L/mol=1.12L;
减少氢氧根离子0.2mol,溶液中增加氢离子0.2mol,c(H+)=
=0.1mol/L,pH=-lgc(H+)=1,
故答案为:1;
(3)根据电解的离子方程式2Cu2++2H2O
2Cu+O2↑+4H+,反应生成铜的物质的量为:0.1mol,生成氧气的物质的量为:0.1mol×
=0.05mol,相当于减少了0.1molCuO,故答案为:0.1;CuO;
(4)如用等质量的两块铜片代替石墨作电极,是镀铜,阳极反应为:Cu-2e-=Cu2+;阴极电极反应为:Cu2++2e-=Cu;电子转移0.2mol,阳极减少质量为0.1mol×64g/mol=6.4g;同时阴极析出铜6.4g,;电解后两铜片的质量相差12.8g,电解质溶液的pH不变,
故答案为:12.8;不变.
(1)电解过程中,溶液中阴离子OH-、SO42-移向阳极,氢氧根离子放电发生氧化反应,电极反应式:4OH--4e-═2H2O+O2↑,故答案为:阳;4OH--4e-═2H2O+O2↑;
(2)依据电极反应电子守恒,生成铜物质的量为0.1mol,电子转移为0.2mol;
阳极反应为4OH--4e-═2H2O+O2↑
0.2mol 0.2mol 0.05mol
阴极反应为2Cu2++4e-═2Cu
0.1mol 0.2mol 0.1mol
所以电解过程中电子转移为0.2mol;
生成氧气的体积=0.05mol×22.4L/mol=1.12L;
减少氢氧根离子0.2mol,溶液中增加氢离子0.2mol,c(H+)=
| 0.2mol |
| 2L |
故答案为:1;
(3)根据电解的离子方程式2Cu2++2H2O
| ||
| 1 |
| 2 |
(4)如用等质量的两块铜片代替石墨作电极,是镀铜,阳极反应为:Cu-2e-=Cu2+;阴极电极反应为:Cu2++2e-=Cu;电子转移0.2mol,阳极减少质量为0.1mol×64g/mol=6.4g;同时阴极析出铜6.4g,;电解后两铜片的质量相差12.8g,电解质溶液的pH不变,
故答案为:12.8;不变.
点评:本题考查了电解原理的应用,电极反应的判断,电极反应的书写方法,电子守恒的计算应用,电镀的原理分析和计算应用.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
下列有关化学实验的操作或说法中,正确的是( )
| A、苯酚中滴加少量的稀溴水出现了三溴苯酚的白色沉淀 |
| B、检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硫酸进行酸化 |
| C、用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体 |
| D、制取溴苯应用液溴、铁屑和苯混合,反应后并用稀碱液洗涤 |
可以用来鉴别甲烷和乙烯,还可以用来除去甲烷中乙烯的操作方法是( )
| A、将混合气体通过盛有硫酸的洗气瓶 |
| B、将混合气体通过盛有足量溴水的洗气瓶 |
| C、将混合气体通过盛有酸性KMnO4溶液的洗气瓶 |
| D、将混合气体通过盛有澄清石灰水的洗气瓶 |
下列有关分类的说法正确的是( )
| A、CH3CH(CH3)2属于链状化合物 |
B、 属于芳香族化合物 属于芳香族化合物 |
C、 属于脂环化合物 属于脂环化合物 |
D、 属于醇类化合物. 属于醇类化合物. |
在4NH4+5O2?4NO+6H2O反应中,表示该反应速率最快的是( )
| A、υ(NH4)=0.8 mol/(L?s) |
| B、υ(O2)=1.0 mol/(L?s) |
| C、υ(NO)=1.0 mol/(L?s) |
| D、υ(H2O)=1.8 mol/(L?s) |
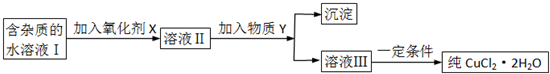
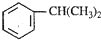 是一种重要的有机化工原料.根据题意完成下列
是一种重要的有机化工原料.根据题意完成下列 是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法
是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法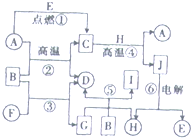 物质A~J之间的转化关系如图所示,其中A、F、H为常见的金属单质,D、E为常见的非金属气态单质,其余的为化合物,且单质E和单质F在点燃条件下可生成淡黄色固体,B在常温常压下为液态化合物.试回答下列问题:
物质A~J之间的转化关系如图所示,其中A、F、H为常见的金属单质,D、E为常见的非金属气态单质,其余的为化合物,且单质E和单质F在点燃条件下可生成淡黄色固体,B在常温常压下为液态化合物.试回答下列问题: