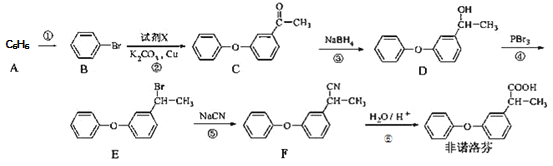
题目内容
【题目】钴的合金及其配合物用途非常广泛。已知![]() 比
比![]() 的氧化性更强,在水溶液中不能大量存在.
的氧化性更强,在水溶液中不能大量存在.
(1)![]() 的核外电子排布式为_____________。
的核外电子排布式为_____________。
(2)无水![]() 的熔点为
的熔点为![]() 、沸点为
、沸点为![]() ,
,![]() 熔点为
熔点为![]() 、沸点为
、沸点为![]() .
.![]() 属于_______晶体,
属于_______晶体,![]() 属于_____晶体。
属于_____晶体。
(3)![]() 可用于激光起爆器等,可由
可用于激光起爆器等,可由![]() 、
、![]() 、
、![]() 共反应制备.
共反应制备.
①![]() 的空间构型为______________________。
的空间构型为______________________。
②![]() 的化学式为
的化学式为![]() ,与
,与![]() (III)形成配位键的原子是_____
(III)形成配位键的原子是_____
已知![]() 的结构式是
的结构式是![]()
③![]() 可以
可以![]() (双聚氰胺)为原料制备,
(双聚氰胺)为原料制备,![]() 双聚氯胺分子中含
双聚氯胺分子中含![]() 键的数目为___________。
键的数目为___________。
(4)![]() 与
与![]() 作用可生成
作用可生成![]() ,其结构如图所示,该分子中
,其结构如图所示,该分子中![]() 原子的杂化方式为_____________________________。
原子的杂化方式为_____________________________。

(5)钴酸锂是常见锂电池的电极材料,其晶胞结构如图所示。该晶胞中氧原子的数目为______。已知![]() 为阿伏加德罗常数的数值,则该晶胞的密度为______(用含
为阿伏加德罗常数的数值,则该晶胞的密度为______(用含![]() 、
、![]() 、
、![]() 的代数式表示)
的代数式表示)![]()
【答案】![]() 离子 分子 正四面体
离子 分子 正四面体 ![]() 和
和
![]() (或
(或![]() )
) ![]() 和
和![]() 6
6 ![]()
【解析】
(1)Co是27号元素,其原子核外有27个电子,失去3d上1个电子和4s上2个电子生成Co3+离子,根据构造原理知Co3+基态的电子排布式;
(2)分子晶体熔沸点较低,离子晶体熔沸点较高,据此解答;
(3)①![]() 中Cl原子为中心原子,则其孤电子对数为0,且其形成了4个
中Cl原子为中心原子,则其孤电子对数为0,且其形成了4个![]() 键,中心原子采取sp3杂化,则空间构型为正四面体。
键,中心原子采取sp3杂化,则空间构型为正四面体。
②![]() 分子中,
分子中,![]() (III)提供空轨道,NH3中的N原子和CO32-中的O原子提供孤对电子,形成配位键;
(III)提供空轨道,NH3中的N原子和CO32-中的O原子提供孤对电子,形成配位键;
③所有单键为![]() 键,双键中有一个
键,双键中有一个![]() 键,由结构式
键,由结构式![]() 可知,
可知,![]() 键数为9;
键数为9;
(4) Co3+有空轨道,而CO有孤电子对,故二者可形成配位键;从结构图中可看出C有的形成两个键,有的形成3个键,故杂化类型分别为sp和sp2杂化;
(5) 题图中原子的堆积方式为六方最密堆积。1pm=1010cm,六棱柱底部正六边形的面积=6![]() (a
(a![]() 10-10)2cm2,六棱柱的体积=6
10-10)2cm2,六棱柱的体积=6![]() (a
(a![]() 10-10)2(b
10-10)2(b![]() 10-10)cm3=3
10-10)cm3=3![]() a2b
a2b![]() 10-30cm3。该晶胞中氧原子的数目为12
10-30cm3。该晶胞中氧原子的数目为12![]() +6
+6![]() +2
+2![]() +1=6,Li原子的数目为3,Co原子的数目为3,已知
+1=6,Li原子的数目为3,Co原子的数目为3,已知![]() 为阿伏加德罗常数的数值,则一个晶胞的质量为
为阿伏加德罗常数的数值,则一个晶胞的质量为![]() g,代入公式
g,代入公式![]() =
=![]() 计算。
计算。
(1)钴是27号元素,根据构造原理可以写出钴离子的核外电子排布式为:![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() ;
;
(2)无水![]() 的熔沸点较高,则
的熔沸点较高,则![]() 属于离子晶体,氯化铁熔沸点较低,则氯化铁属于分子晶体,
属于离子晶体,氯化铁熔沸点较低,则氯化铁属于分子晶体,
因此,本题正确答案是:离子;分子;
(3)①![]() 中Cl原子为中心原子,则其孤电子对数为0,且其形成了4个
中Cl原子为中心原子,则其孤电子对数为0,且其形成了4个![]() 键,中心原子采取sp3杂化,则空间构型为正四面体。
键,中心原子采取sp3杂化,则空间构型为正四面体。
②![]() 分子中,
分子中,![]() (III)提供空轨道,NH3中的N原子和CO32-中的O原子提供孤对电子,形成配位键,所以与
(III)提供空轨道,NH3中的N原子和CO32-中的O原子提供孤对电子,形成配位键,所以与![]() (III)形成配位键的原子是
(III)形成配位键的原子是![]() 和
和![]() ,
,
③所有单键为![]() 键,双键中有一个
键,双键中有一个![]() 键,由结构式
键,由结构式![]() 可知,
可知,![]() 键数为9,则
键数为9,则![]() 双聚氯胺分子中
双聚氯胺分子中![]() 键的数目为
键的数目为![]() 。
。
因此,本题正确答案是:正四面体;![]() 和
和![]() ;
;![]() (或
(或![]() );
);
(4)从结构图中可看出C有的形成两个键,有的形成3个键,故杂化类型分别为sp和sp2杂化,
因此,本题正确答案是:sp和sp2。
(5)题图中原子的堆积方式为六方最密堆积。1pm=1010cm,六棱柱底部正六边形的面积=6![]() (a
(a![]() 10-10)2cm2,六棱柱的体积=6
10-10)2cm2,六棱柱的体积=6![]() (a
(a![]() 10-10)2(b
10-10)2(b![]() 10-10)cm3=3
10-10)cm3=3![]() a2b
a2b![]() 10-30cm3。该晶胞中氧原子的数目为12
10-30cm3。该晶胞中氧原子的数目为12![]() +6
+6![]() +2
+2![]() +1=6,Li原子的数目为3,Co原子的数目为3,已知
+1=6,Li原子的数目为3,Co原子的数目为3,已知![]() 为阿伏加德罗常数的数值,则一个晶胞的质量为
为阿伏加德罗常数的数值,则一个晶胞的质量为![]() g,故密度为
g,故密度为![]() =
=![]() =
=![]() 。
。
因此,本题正确答案是:![]() 。
。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案