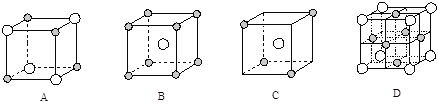
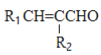题目内容
【题目】LiFePO4是一种电动汽车电池的电极材料,实验室以绿矾和磷酸为原料制备LiFePO4的流程如下:

(1)“溶解”和“反应1”步骤不能互换的原因是________。
(2)“反应1”的离子方程式是________。
(3)“反应2”是2LiOH+6H2C2O4+2FePO4===2LiFePO4+7CO2↑+5CO↑+7H2O,其中体现氧化性和还原性的反应物的物质的量之比为________。
(4)LiFePO4需要在高温下成型才能作为电极,高温成型时要加入少量活性炭黑,其作用是:①________,②________。
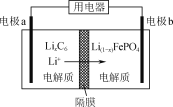
(5)利用LiFePO4作电极的电池稳定、安全、对环境友好,放电时工作原理如图所示。放电时电极b的电极反应式为_________。
【答案】可能导致FePO4中混有较多Fe(OH)3 2Fe2++ClO-+2H3PO4+4OH-===2FePO4↓+Cl-+5H2O 9∶7 改善成型后LiFePO4(或电极)的导电作用 与空气中O2反应,防止LiFePO4中的Fe2+被氧化 Li(1-x)FePO4+xLi++xe-===LiFePO4
【解析】
(1)“溶解”时溶液保持酸性,抑制亚铁离子的水解,保持离子浓度较高,“反应1”生成FePO4,步骤不能互换,否则可能导致FePO4中混有较多Fe(OH)3;
(2)“反应1”在磷酸存在下,加入氢氧化钠时亚铁离子被次氯酸根离子氧化生成FePO4,反应的离子方程式是2Fe2++ClO-+2H3PO4+4OH-===2FePO4↓+Cl-+5H2O;
(3)“反应2”是2LiOH+6H2C2O4+2FePO4===2LiFePO4+7CO2↑+5CO↑+7H2O,反应中碳元素由+3价降为+2价、铁元素由+3价降为+2价;碳元素由+3价升为+4价,根据氧化还原反应原理,每生成2molLiFePO4,则生成7mol CO2,转移7mole-,故体现氧化性的反应物H2C2O4、FePO4和还原性的反应物H2C2O4的物质的量之比为(2.5+2):3.5=9:7;
(4)LiFePO4需要在高温下成型才能作为电极,高温成型时要加入少量活性炭黑,其作用是:①改善成型后LiFePO4(或电极)的导电作用,②与空气中O2反应,防止LiFePO4中的Fe2+被氧化;
(5)利用LiFePO4作电极的电池稳定、安全、对环境友好,放电时工作原理如图所示。放电时锂离子通过隔膜向电极b移动,则电极b为正极,电极上Li+得电子产生LiFePO4,电极反应式为Li(1-x)FePO4+xLi++xe-===LiFePO4。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案