题目内容
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A、明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、在海轮外壳上镶入锌块,可减缓船体的腐蚀 |
| C、电解MgCl2饱和溶液,可制得金属镁 |
| D、MgO的熔点很高,可用于制作耐高温材料 |
考点:金属的电化学腐蚀与防护,金属冶炼的一般原理,镁、铝的重要化合物
专题:电化学专题,几种重要的金属及其化合物
分析:A、胶体能净化水;
B、锌块作原电池负极被腐蚀,从而保护铁被腐蚀;
C、活泼金属采用电解其熔融盐的方法冶炼;
D、根据氧化镁的性质判断其用途.
B、锌块作原电池负极被腐蚀,从而保护铁被腐蚀;
C、活泼金属采用电解其熔融盐的方法冶炼;
D、根据氧化镁的性质判断其用途.
解答:
解:A、明矾中含有铝元素,铝能水解生成氢氧化铝胶体,胶体具有吸附性而吸附水中的悬浮物所以能净水,故A正确;
B、锌、铁和海水构成原电池,锌作负极,铁作正极,负极锌失电子被腐蚀,从而保护了铁被腐蚀,故B正确;
C、镁是活泼金属,电解其水溶液时,阴极上氢离子得电子而不是镁离子得电子,所以得不到金属镁,应采用电解其熔融盐的方法冶炼,故C错误;
D、氧化镁的熔点较高,所以能制作耐高温材料,故D正确.
故选:C.
B、锌、铁和海水构成原电池,锌作负极,铁作正极,负极锌失电子被腐蚀,从而保护了铁被腐蚀,故B正确;
C、镁是活泼金属,电解其水溶液时,阴极上氢离子得电子而不是镁离子得电子,所以得不到金属镁,应采用电解其熔融盐的方法冶炼,故C错误;
D、氧化镁的熔点较高,所以能制作耐高温材料,故D正确.
故选:C.
点评:本题考查了化学知识在日常生活中的应用,难度不大,易错选项是A,注意氢氧化铝胶体具有吸附性.

练习册系列答案
相关题目
下列有关叙述正确的是( )
| A、苯分子是碳碳单双键交替相连的结构,因此苯环上碳碳键的键长都不相等 |
| B、甲烷分子是以碳原子为中心的四面体结构,CCl4却不是正四面体结构 |
C、 属于脂环化合物 属于脂环化合物 |
| D、苯是一种无色液体,难溶于水,密度比水小 |
五种短周期元素的原子半径及主要化合价如下,下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.104 | 0.111 | 0.066 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、R的氧化物及其对应的水化物均具有两性 |
| B、L、M的单质均用电解其熔融盐的方法冶炼 |
| C、T的氢化物还原性及稳定性均比Q的氢化物强 |
| D、五种元素的常见简单离子中半径最大的是Q2- |
下面是一种三肽,它可以看作是3个氨基酸缩合而得到的产物
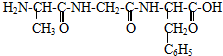
现有一个多肽分子,分子式为CXHYN12OD(X,Y,D为自然数)将它完全水解后只得到下列三种氨基酸
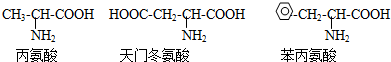
现将一个该多肽分子水解后,得到天门冬氨酸的分子个数为( )
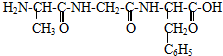
现有一个多肽分子,分子式为CXHYN12OD(X,Y,D为自然数)将它完全水解后只得到下列三种氨基酸
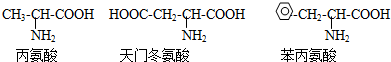
现将一个该多肽分子水解后,得到天门冬氨酸的分子个数为( )
| A、D-12 | ||
| B、D-13 | ||
C、
| ||
D、
|
硫酸亚铁铵是一种重要的化工原料,以下各组溶液中加入该盐后,选项中各离子数目均没有明显减少的是( )
| A、Na+ H+ Cl- NO3- |
| B、Na+ Mg2+ Cl- SO42- |
| C、K+ Ba2+ OH- I- |
| D、K+ S2- Br- Cl- |
下列说法中正确的是( )
①钠在空气中燃烧生成白色的固体氧化钠
②钠投入硫酸铜溶液中有红色粉末产生
③过氧化钠可在防毒面具中做供氧剂
④铁丝在氯气中燃烧产生大量红棕色的烟
⑤氢气在氯气中燃烧能产生大量的白烟.
①钠在空气中燃烧生成白色的固体氧化钠
②钠投入硫酸铜溶液中有红色粉末产生
③过氧化钠可在防毒面具中做供氧剂
④铁丝在氯气中燃烧产生大量红棕色的烟
⑤氢气在氯气中燃烧能产生大量的白烟.
| A、①② | B、②③ | C、③④ | D、④⑤ |
设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
| A、常温下,1L pH=1的硫酸溶液中含有的H+为0.1NA |
| B、常温下,14g C2H4和C3H6的混合气体中含有2NA个氢原子 |
| C、2.3g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA |
| D、1mol甲醇中含有C-H键的数目为4NA |
 ;
;
 和
和 也可以发生类似反应①的反应,有机产物的结构简式为
也可以发生类似反应①的反应,有机产物的结构简式为