题目内容
下表是几种弱电解质的电离平衡常数(25℃).
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO
③C6H5OH均可看作酸,则它们酸性由强到弱的顺序为 (填编号);
(2)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式 .
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-) c(NH4+)(填“>”、“=”或“<”).
(4)25℃时,向10m L 0.01mol?L-1苯酚溶液中滴加Vml 0.01mol?L-1氨水,混合溶液中粒子浓度关系正确的是 .
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度大于10ml 0.01mol?L-1苯酚溶液中水的电离程度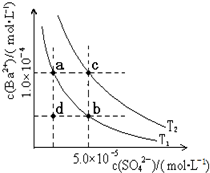
(5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
①T1 T2(填>、=、<),T2温度时Ksp(BaSO4)= ;
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是
A、加入Na2SO4可使溶液由a点变为b点
B、在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C、蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D、升温可使溶液由b点变为d点.
| 电解质 | 平衡方程式 | 平衡常数K | ||||||
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | ||||||
| H2CO3 | H2CO3?H++HCO
HCO
|
K1=4.31×10-7 K2=5.61×10-11 | ||||||
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | ||||||
| NH3?H2O | NH3?H2O?NH4++OH- | 1.76×10-5 |
(1)由上表分析,若①CH3COOH ②HCO
- 3 |
(2)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
(4)25℃时,向10m L 0.01mol?L-1苯酚溶液中滴加Vml 0.01mol?L-1氨水,混合溶液中粒子浓度关系正确的是
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度大于10ml 0.01mol?L-1苯酚溶液中水的电离程度

(5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
①T1
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是
A、加入Na2SO4可使溶液由a点变为b点
B、在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C、蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D、升温可使溶液由b点变为d点.
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:(1)酸的电离常数越大,其酸性越强;
(2)水解平衡常数等于生成物浓度系数次幂之积与反应物浓度系数次幂之积的比;
(3)等体积等浓度的醋酸和氨水混合,二者恰好反应生成醋酸铵,根据醋酸和氨水的相对强弱判断其溶液酸碱性,再根据电荷守恒判断离子浓度;
(4)一水合氨的电离程度大于苯酚,则苯酚铵溶液呈碱性,根据溶液pH结合电荷守恒解答;
(5)①难溶物的溶解平衡是吸热反应,升高温度促进溶解,Ksp(BaSO4)=c(Ba2+).c(SO42-);
②A、加人Na2SO4后平衡逆向移动,但仍在线上移动;
B、在T1曲线上方区域(不含曲线)任意一点时,均为BaSO4过饱和溶液;
C、蒸发溶剂,增大溶液中溶质的浓度,温度不变,溶度积常数不变;
D.升温增大溶质的溶解,溶液中钡离子、硫酸根离子浓度都增大.
(2)水解平衡常数等于生成物浓度系数次幂之积与反应物浓度系数次幂之积的比;
(3)等体积等浓度的醋酸和氨水混合,二者恰好反应生成醋酸铵,根据醋酸和氨水的相对强弱判断其溶液酸碱性,再根据电荷守恒判断离子浓度;
(4)一水合氨的电离程度大于苯酚,则苯酚铵溶液呈碱性,根据溶液pH结合电荷守恒解答;
(5)①难溶物的溶解平衡是吸热反应,升高温度促进溶解,Ksp(BaSO4)=c(Ba2+).c(SO42-);
②A、加人Na2SO4后平衡逆向移动,但仍在线上移动;
B、在T1曲线上方区域(不含曲线)任意一点时,均为BaSO4过饱和溶液;
C、蒸发溶剂,增大溶液中溶质的浓度,温度不变,溶度积常数不变;
D.升温增大溶质的溶解,溶液中钡离子、硫酸根离子浓度都增大.
解答:
解:(1)酸的电离常数越大,其酸性越强,这三种微粒的电离平衡常数大小顺序是CH3COOH>C6H5OH>HCO3-,所以它们酸性由强到弱的顺序为①③②,
故答案为:①③②;
(2)Kh=
,故答案为:
;
(3)一水合氨和醋酸的电离程度相等,等体积等浓度的醋酸和氨水混合时,二者恰好反应生成醋酸铵,铵根离子和醋酸根离子水解程度相等,所以醋酸铵溶液呈中性,根据电荷守恒得c(CH3COO-)=c(NH4+),故答案为:=;
(4)A.苯酚的电离平衡常数小于一水合氨,所以苯酚铵溶液呈碱性,若混合液pH>7,则V≥10也可能小于10,故A错误;
B.若混合液pH<7,则苯酚过量,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(NH4+)<c(C6H5O-),故B错误;
C.酸或碱抑制水电离,含有弱离子的盐促进水电离,V=10时二者恰好反应生成苯酚铵,混合液中水的电离程度大于10ml 0.01mol?L-1苯酚溶液中水的电离程度,故C正确;
故选C;
(5)①难溶物的溶解平衡是吸热反应,升高温度促进溶解,则溶度积常数越大,根据图象知T1的溶度积常数小于T2,所以T1<T2,Ksp(BaSO4)=c(Ba 2+ ).c(SO42- )=1.0×10-4×5.0×10-5=5×10-9,故答案为:<;5×10-9;
②A.硫酸钠抑制硫酸钡电离,硫酸根离子浓度增大,导致溶液中钡离子浓度减小,所以可以使溶液由a点变为b点,故A正确;
B.在T1曲线上方区域(不含曲线)为过饱和溶液,所以有晶体析出,故B正确;
C.蒸发溶剂,增大溶液中溶质的浓度,温度不变,溶度积常数不变,所以蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b),故C正确;
D.升温增大溶质的溶解,溶液中钡离子、硫酸根离子浓度都增大,故D错误;
故选ABC.
故答案为:①③②;
(2)Kh=
| c(HCO3-).c(OH-) |
| c(CO32-) |
| c(HCO3-).c(OH-) |
| c(CO32-) |
(3)一水合氨和醋酸的电离程度相等,等体积等浓度的醋酸和氨水混合时,二者恰好反应生成醋酸铵,铵根离子和醋酸根离子水解程度相等,所以醋酸铵溶液呈中性,根据电荷守恒得c(CH3COO-)=c(NH4+),故答案为:=;
(4)A.苯酚的电离平衡常数小于一水合氨,所以苯酚铵溶液呈碱性,若混合液pH>7,则V≥10也可能小于10,故A错误;
B.若混合液pH<7,则苯酚过量,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(NH4+)<c(C6H5O-),故B错误;
C.酸或碱抑制水电离,含有弱离子的盐促进水电离,V=10时二者恰好反应生成苯酚铵,混合液中水的电离程度大于10ml 0.01mol?L-1苯酚溶液中水的电离程度,故C正确;
故选C;
(5)①难溶物的溶解平衡是吸热反应,升高温度促进溶解,则溶度积常数越大,根据图象知T1的溶度积常数小于T2,所以T1<T2,Ksp(BaSO4)=c(Ba 2+ ).c(SO42- )=1.0×10-4×5.0×10-5=5×10-9,故答案为:<;5×10-9;
②A.硫酸钠抑制硫酸钡电离,硫酸根离子浓度增大,导致溶液中钡离子浓度减小,所以可以使溶液由a点变为b点,故A正确;
B.在T1曲线上方区域(不含曲线)为过饱和溶液,所以有晶体析出,故B正确;
C.蒸发溶剂,增大溶液中溶质的浓度,温度不变,溶度积常数不变,所以蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b),故C正确;
D.升温增大溶质的溶解,溶液中钡离子、硫酸根离子浓度都增大,故D错误;
故选ABC.
点评:本题考查较综合,涉及弱电解质电离、难溶物的溶解平衡、盐类水解等知识点,根据弱酸电离平衡常数及弱酸根离子水解程度的关系来分析解答,明确难溶物溶解平衡曲线变化趋势、纵横坐标的含义,知道不饱和转化为饱和溶液的方法,题目难度中等.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
硼的原子序数为5,硼的最高价含氧酸的化学式不可能是( )
| A、HBO2 |
| B、H3BO3 |
| C、H2BO3 |
| D、H4B2O5 |
空气、水、土壤及食品的污染,一定程度影响了人类生活,下列有关说法错误的是( )
| A、雾霾天气中的主要污染物是PM2.5,其中含氮的有机物和光发生化学作用,可形成光化学烟雾 |
| B、砷是水污染的重要因素之一,其最高价含氧酸砷酸的酸性比磷酸酸性弱 |
| C、土壤污染物可分为无机污染物和有机污染物,农药污染多为有机污染物 |
D、苏丹红是人工合成的一种工业染料,若掺入饲料中饲养禽类会污染蛋类食品,它的结构简式是 ,其分子式是:C22H18N4O ,其分子式是:C22H18N4O |
处于平衡状态的反应2H2S(g)?2H2(g)+S2(g)△H>0,不改变其他条件的情况下合理的说法是( )
| A、加入催化剂,反应途径将发生改变,△H也将随之改变 |
| B、升高温度,正逆反应速率都增大,H2S分解率也增大 |
| C、增大压强,平衡向逆反应方向移动,将引起体系温度降低 |
| D、若体系恒容,注人一些H2后达新平衡,H2浓度将减小 |
下列反应的离子方程式正确的是( )
| A、二氧化硫气体通入到漂白粉溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| B、碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
| C、H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑ |
| D、向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: 图为周期表的一小部分,A、B、C、D的位置关系如图所示.且它们均为短周期元素,其中C元素的最外层电子数是电子层数的2倍,回答下列问题:
图为周期表的一小部分,A、B、C、D的位置关系如图所示.且它们均为短周期元素,其中C元素的最外层电子数是电子层数的2倍,回答下列问题: 以黄铜矿精矿为原料,制取金属铜的工艺如下所示:
以黄铜矿精矿为原料,制取金属铜的工艺如下所示: 生产生活中广泛涉及氧化还原反应.
生产生活中广泛涉及氧化还原反应.