题目内容
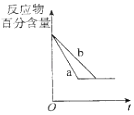
【题目】在体积为V L的恒容密闭容器中盛有一定量H2 , 通入Br2(g)发生反应H2(g)+Br2(g)2HBr(g)△H<0.当温度分别为T1、T2 , 平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( ) 
A.若b、c两点的平衡常数分别为K1、K2 , 则K1>K2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率可采取增加Br2(g)通入量的方法
D.b、c两点的HBr的体积分数b>c
【答案】B
【解析】解:A.△H<0,为放热反应,降低温度平衡正向移动,氢气的体积分数减小,则T1>T2 , 则K1<K2 , 故A错误; B.a、b两点温度相同,b点溴的浓度越大,反应速率为b>a,故B正确;
C.增加Br2(g),其转化率减小,而氢气的转化率增大,故C错误;
D.HBr的体积分数越大,氢气的体积分数越小,则b、c两点的HBr的体积分数b<c,故D错误;
故选B.
A.△H<0,为放热反应,降低温度平衡正向移动,氢气的体积分数减小,则T1>T2;
B.浓度越大,反应速率越快;
C.增加Br2(g),其转化率减小;
D.HBr的体积分数越大,氢气的体积分数越小.

【题目】请回答下列问题:
(1)纯水在T℃时,pH=6,该温度下1molL﹣1的NaOH溶液中,由水电离出的c(OH﹣)=molL﹣1 .
(2)某一元弱酸溶液(A)与二元强酸(B)的pH相等.若将两溶液稀释相同的倍数后,pH(A)pH(B) (填“>”、“=”或“<”).现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A)V(B)(填“>”、“=”或“<”).
(3)已知:二元酸H2R 的电离方程式是:H2R=H++HR﹣ , HR﹣R2﹣+H+ , 若0.1molL﹣1NaHR溶液的c(H+)=a molL﹣1 , 则0.1molL﹣1H2R溶液中c(H+)(0.1+a) molL﹣1(填“<”、“>”或“=”),理由是 .
(4)电离平衡常数是衡量弱电解质电离程度的物理量.已知:
化学式 | 电离常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
①25℃时,有等浓度的HCN溶液、H2CO3溶液和CH3COOH溶液,三溶液的pH由大到小的顺序为(用化学式表示).
②向NaCN溶液中通入少量的CO2 , 发生反应的化学方程式为 .