题目内容
19.下列关于含氯消毒剂的解释不正确的是( )| A. | 室温下,氯气通入NaOH溶液中制得漂白液Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 氯水具有杀菌消毒作用:Cl2+H2O=HCl+HClO | |
| C. | 氯水应避光保存的原因是:2HClO$\frac{\underline{\;光\;}}{\;}$H2O+Cl2↑ | |
| D. | 向Ca(ClO)2溶液中通入适量CO2可增强漂白效果:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO |
分析 A.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
B.次氯酸具有强氧化性,能够杀菌消毒;
C.次氯酸分解生成氯化氢和氧气,不会生成氯气;
D.次氯酸钙与二氧化碳反应生成碳酸钙沉淀和次氯酸.
解答 解:A.室温下,氯气通入NaOH溶液中制得漂白液,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故A正确;
B.氯气与水的反应为:Cl2+H2O=HCl+HClO,生成的次氯酸具有强氧化性,则氯水具有杀菌消毒作用,故B正确;
C.氯水应避光保存的原因是次氯酸见光分解生成氯化氢和氧气,正确的反应为:2HClO$\frac{\underline{\;光\;}}{\;}$2HCl+O2↑,故C错误;
D.向Ca(ClO)2溶液中通入适量CO2可增强漂白效果,发生反应为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,故D正确;
故选C.
点评 本题考查了化学方程式、离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式、化学方程式的书写原则,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
9.我国古代用炉甘石炼锌,主要反应为2C+ZnCO3 $\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑,该反应属于( )
| A. | 置换反应 | B. | 化合反应 | C. | 分解反应 | D. | 复分解反应 |
10.已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol
下列说法不正确的是( )
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol
| 气态分子中的化学键 | 断开1mol化学键所需的能量/kJ |
| O-H | 463 |
| O=O | 498 |
| A. | 氢气的燃烧热是△H=-241.8 kJ/mol | |
| B. | 断开1mol H-H键需要吸收435.2 kJ的能量 | |
| C. | 相同条件下,1 molH2O(g)比1 mol H2O(l)能量高 | |
| D. | 18 g H2O(l)完全分解生成氢气和氧气,需要吸收285.8 kJ的能量 |
7.香兰素是重要的香料之一,它可由丁香酚经多步反应合成.

有关上述两种化合物的说法错误的是( )

有关上述两种化合物的说法错误的是( )
| A. | 丁香酚与香兰素都能与H2发生加成反应 | |
| B. | 常温下,1 mol丁香酚最多消耗1 mol Br2 | |
| C. | 丁香酚和香兰素遇FeCl3溶液都能发生显色反应 | |
| D. | 常温下,丁香酚与香兰素都能与浓溴水发生反应 |
14.有关2L 0.1mol/L K2SO4溶液的叙述正确的是( )
| A. | 含有0.1 mol K2SO4 | |
| B. | 水的体积为2L | |
| C. | K+的物质的量浓度为0.2 mol/L | |
| D. | 取出1 L溶液后,浓度变为0.05 mol/L |
4.为了检验浓硫酸与木炭加热后产生的三种物质,将混合气体缓慢通过检验试剂,并记录现象,下列实验能够达到目的是( )
| 选项 | 实验流程及现象 |
| A | 酸性高锰酸钾溶液→澄清石灰水→无水硫酸铜 紫色褪去 变浑浊 变蓝 |
| B | 无水硫酸铜→酸性高锰酸钾溶液→澄清石灰水 变蓝 紫色褪去 变浑浊 |
| C | 无水硫酸铜→品红→酸性高锰酸钾溶液→澄清石灰水 变蓝 褪色 紫色褪去 变浑浊 |
| D | 无水硫酸铜→酸性高锰酸钾溶液→澄清石灰水 变蓝 紫色变浅 变浑浊 |
| A. | A | B. | B | C. | C | D. | D |
11.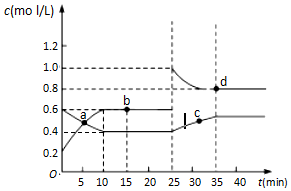 已如NO2与N2O4相互转化:2NO2(g)?N2O4(g)△H=-24.4kJ/mol,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2L的密闭容器中,其中物质的量浓度随时间变化的关系如图.下列分析合理的是( )
已如NO2与N2O4相互转化:2NO2(g)?N2O4(g)△H=-24.4kJ/mol,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2L的密闭容器中,其中物质的量浓度随时间变化的关系如图.下列分析合理的是( )
 已如NO2与N2O4相互转化:2NO2(g)?N2O4(g)△H=-24.4kJ/mol,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2L的密闭容器中,其中物质的量浓度随时间变化的关系如图.下列分析合理的是( )
已如NO2与N2O4相互转化:2NO2(g)?N2O4(g)△H=-24.4kJ/mol,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2L的密闭容器中,其中物质的量浓度随时间变化的关系如图.下列分析合理的是( )| A. | 前l0min内,用v(NO2)表示的该反应速率为0.02mol/(L•min) | |
| B. | 反应进行到l0 min时,体系吸收的热量为9.76 kJ | |
| C. | b点的速率大于c点的速率 | |
| D. | 25min时,导致平衡移动原因是增大压强 |
7.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)?N2(g)+2CO2(g),下列说法中不正确的是( )
| A. | NO的消耗速率等于CO2的生成速率时,反应不一定达到平衡 | |
| B. | CO的消耗速率是N2消耗速率的两倍时达到平衡 | |
| C. | 反应达到平衡后,NO的浓度等于CO2的浓度 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
