题目内容
下列有关物质性质或用途的说法正确的是( )
| A、浓硫酸可用作干燥剂是因为其具有强氧化性 |
| B、利用Al2O3制作的坩埚,可用于熔融烧碱 |
| C、制水泥和玻璃都用石灰石作原料 |
| D、铜的金属活泼性比铁的弱,铜不能与任何强酸发生反应. |
考点:浓硫酸的性质,镁、铝的重要化合物,铜金属及其重要化合物的主要性质
专题:元素及其化合物,化学应用
分析:A.浓硫酸具有吸水性;
B.氧化铝为两性氧化物能够与氢氧化钠反应;
C.水泥原料是石灰石和黏土;玻璃原料是纯碱、石灰石和石英;
D.铜与硝酸能发生氧化还原反应.
B.氧化铝为两性氧化物能够与氢氧化钠反应;
C.水泥原料是石灰石和黏土;玻璃原料是纯碱、石灰石和石英;
D.铜与硝酸能发生氧化还原反应.
解答:
解:A.浓硫酸可用作干燥剂是因为其具有吸水性,故A错误;
B.氧化铝为两性氧化物能够与氢氧化钠反应生成偏铝酸钠,故B错误;
C.水泥原料是石灰石和黏土;玻璃原料是纯碱、石灰石和石英,制水泥和玻璃都用石灰石作原料,故C正确;
D.铜与稀硝酸反应生成硝酸铜、水和一氧化氮,故D错误;
故选:C.
B.氧化铝为两性氧化物能够与氢氧化钠反应生成偏铝酸钠,故B错误;
C.水泥原料是石灰石和黏土;玻璃原料是纯碱、石灰石和石英,制水泥和玻璃都用石灰石作原料,故C正确;
D.铜与稀硝酸反应生成硝酸铜、水和一氧化氮,故D错误;
故选:C.
点评:本题考查了元素及化合物知识,题目难度不大,熟悉浓硫酸、氧化铝的性质是解题关键,注意制备水泥玻璃的原料.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
常温下,下列溶液中有关物质的量浓度关系和计算不正确的是( )
| A、c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4C1溶液中,溶质物质的量浓度大小关系是:c(NH4Cl)>c[(NH4)2SO4]>c[(NH4)2Fe(SO4)2] |
| B、已知25℃时Ksp(AgCl)=1.8×10-10,则在0.1 mol?L-l A1Cl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol?L-l |
| C、25℃时0.2 mol?L-l HC1溶液与等体积0.05 mol?L-l Ba(OH)2溶液混合后,溶液的pH约为1 |
| D、0.1mol?L-l NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(A2-)>c(H2A) |
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组( )
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 甲 | CO2 | HCl | CO2 | NO2 | CO2 |
| 乙 | SO2 | CO2 | SO2 | SO2 | NH3 |
| 丙 | 石灰水 | 石灰水 | Ba(NO3)2 | BaCl2 | CaCl2 |
| A、①②③④⑤ | B、②③④⑤ |
| C、①③④ | D、①②③④ |
下列实验能达到目的是( )
| A、将NH4Cl溶液蒸干制备NH4Cl固体 |
| B、只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
| C、用萃取分液的方法除去酒精中的水 |
| D、用可见光束照射以区别溶液和胶体 |
下列溶液中与50mL 1mol/L氯化铝溶液中的c(Cl-)相等的是( )
| A、150mL 1mol/L氯化钠溶液 |
| B、75mL 2mol/L 氯化铵溶液 |
| C、150mL 1mol/L氯化钾溶液 |
| D、75mL 3mol/L氯化钾溶液 |
下列有关物质的表达式不正确的是( )
| A、乙烯的最简式:C2H4 |
| B、CS2分子的结构式:S═C═S |
| C、醛基的结构简式:-CHO |
D、-OH(羟基)的电子式为: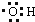 |

