题目内容
将10.0g铁屑溶于105mL 2mol?L-1的稀硫酸中,完全反应后收集到标准状况下的氢气3.36L,若溶液体积的变化忽略不计.列式计算:
(1)已知杂质不与硫酸反应.则铁屑中单质铁的含量是多少?
(2)反应后的溶液中,H+的物质的量浓度是多少?
(1)已知杂质不与硫酸反应.则铁屑中单质铁的含量是多少?
(2)反应后的溶液中,H+的物质的量浓度是多少?
考点:化学方程式的有关计算
专题:计算题
分析:(1)n(H2SO4)=2mol/L×0.105L=0.21mol,n(H2)=
=0.15mol<n(H2SO4),所以混合溶液中硫酸有剩余,根据氢气和铁之间的关系式计算铁的质量,再根据质量分数公式计算铁的含量;
(2)根据氢原子守恒计算反应后的溶液中氢离子浓度.
| 3.36L |
| 22.4L/mol |
(2)根据氢原子守恒计算反应后的溶液中氢离子浓度.
解答:
解:(1)n(H2SO4)=2mol/L×0.105L=0.21mol,n(H2)=
=0.15mol<n(H2SO4),所以混合溶液中硫酸有剩余,设铁的质量为x,
Fe---H2,
1mol 1mol
x 0.15mol
1mol:1mol=x:0.15mol,
x=0.15mol,
铁的含量=
×100%=84%,
答:铁屑中单质铁的含量是84%;
(2)根据氢原子守恒得,反应后的溶液中氢离子浓度=
=1.14mol/L,
答:反应后溶液中氢离子浓度为1.14mol/L.
| 3.36L |
| 22.4L/mol |
Fe---H2,
1mol 1mol
x 0.15mol
1mol:1mol=x:0.15mol,
x=0.15mol,
铁的含量=
| 56g/mol×0.15mol |
| 10.0g |
答:铁屑中单质铁的含量是84%;
(2)根据氢原子守恒得,反应后的溶液中氢离子浓度=
| 2mol/L×0.105L×2-0.15mol×2 |
| 0.105L |
答:反应后溶液中氢离子浓度为1.14mol/L.
点评:本题考查了根据方程式进行计算,明确反应中各个物理量之间的关系式即可解答,注意结合原子守恒来解答,题目难度不大.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
同温同压下,等质量NO2和CO2相比较,下列叙述中正确的是( )
| A、体积之比为1:1 |
| B、体积之比为22:23 |
| C、物质的量之比为23:22 |
| D、密度之比为22:23 |
在2A+B?3C+5D的反应中,下列措施一定能加快反应速率的是( )
| A、增加A的量 | B、增大压强 |
| C、升高温度 | D、减少C的量 |
当两极都用银片作电极电解硝酸银水溶液时,在阳极的产物是( )
| A、只有银 | B、只有氢气 |
| C、银和氢气 | D、上述都不对 |
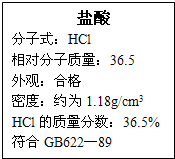 右图为某市售盐酸试剂瓶标签上的部分数据,通过计算回答:
右图为某市售盐酸试剂瓶标签上的部分数据,通过计算回答: