题目内容
2.下列实验装置不能达到实验目的是( )| A. |  用稀硫酸吸收氨气 | B. |  验证Cu与浓硝酸反应的热量变化 | ||
| C. |  萃取时振荡分液漏斗 | D. |  比较Na2CO3与NaHCO3的热稳定性 |
分析 A.氨气不溶于四氯化碳,该装置能够防止倒吸,可吸收氨气;
B.根据U形管两端液面变化可判断反应是否属于放热反应;
C.振荡时,用右手掌压紧盖子,左手用拇指、食指和中指握住活塞,把漏斗倒转过来振荡;
D.硝酸根中温度降低,碳酸氢钠应放在套装小试管中.
解答 解:A.四氯化碳密度大于稀硫酸,可以将稀硫酸与氨气隔离,可防倒吸,氨气与稀硫酸反应,可用水吸收氨气,故A不选;
B.如反应为放热反应,则U形管左端液面下降,右端液面上升,可判断反应是否属于放热反应,故B不选;
C.为提高萃取效果,萃取时需要振荡分液漏斗,图示操作方法合理,能够达到实验目的,故C不选;
D.套装小试管加热温度较低,碳酸氢钠应放在套装小试管中,通过澄清石灰水是否变浑浊可证明稳定性,故D选;
故选D.
点评 本题考查较为综合,涉及气体吸收、化学反应与能量变化以及碳酸钠和碳酸氢钠的热稳定性的比较,为高考常见题型,侧重于学生的分析能力、实验能力和评价能力的考查,注意把握物质的性质的异同以及实验的严密性的判断,难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
19.图中,R、W、X、Y、Z为元素周期表中前四周期的部分元素,下列有关叙述正确的是( )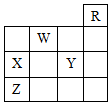

| A. | 五种元素中,只有Z为金属元素 | |
| B. | W位于ⅥA族,有+6、-2两种常见化合价 | |
| C. | X和Y的最高价氧化物对应水化物都是强酸 | |
| D. | X、Y、Z的气态氢化物的稳定性:Y>X>Z |
20.密闭容器中充入1mol N2和3mol H2,一定条件下反应达平衡.下列说法正确的是( )
| A. | 生成2 mol NH3 | |
| B. | 正反应和逆反应的速率都为零 | |
| C. | N2、H2和NH3的物质的量浓度相等 | |
| D. | N2、H2和NH3的物质的量浓度不再变化 |
10.下列有关铝及其化合物的说法正确的是( )
| A. | 可用NaOH溶液除去Fe2O3中的Al2O3 | |
| B. | 铝表面有氧化膜保护,铝锅可以长时间盛放酸性溶液 | |
| C. | 氯化铝溶液与NaOH溶液互滴现象完全相同 | |
| D. | 实验室常用NaOH溶液和AlCl3溶液制备Al(OH)3 |
17.根据元素周期表推测Fe元素在周期表中位于第四周期( )
| A. | 第ⅢB族 | B. | 第Ⅲ族 | C. | 第VⅢ族 | D. | 第VⅢB族 |
7. 如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细.由此判断表中所列M、N、P物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细.由此判断表中所列M、N、P物质,其中可以成立的是( )
 如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细.由此判断表中所列M、N、P物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细.由此判断表中所列M、N、P物质,其中可以成立的是( )| M | N | P | |
| A | Zn | Cu | 稀H2SO4溶液 |
| B | Cu | Fe | 稀HCl溶液 |
| C | Ag | Zn | AgNO3溶液 |
| D | Zn | Fe | CuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
14.下列各组中化合物的性质比较,不正确的是( )
| A. | 酸 性:HClO4>HBrO4>HIO4 | B. | 碱性:NaOH>Mg(OH)2>A l(OH)3 | ||
| C. | 非金属性:F>O>S | D. | 稳 定 性:HCl>PH3>H2S |
11.对下列事实的解释正确的是( )
| A. | 久置的浓硝酸变黄,是混有三氯化铁 | |
| B. | 吸收塔里吸收SO3,直接用浓硫酸而不用水,是为了防止产生酸雾 | |
| C. | 常温下,将铜放入浓硫酸中无明显变化,说明铜在冷的浓硫酸中钝化 | |
| D. | 可用同一原理解释浓硫酸和浓硝酸长期暴露在空气中浓度均降低 |
10.X的核外电子排布为2、8、8,则X元素在周期表中的位置是( )
| A. | 第四周期第ⅡA族 | B. | 第三周期第ⅡA族 | C. | 第三周期第ⅥA族 | D. | 第三周期第0族 |