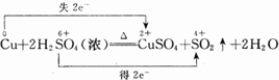
题目内容
在Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O反应中,若有3.2g的Cu参与反应,则被还原的H2SO4的物质的量是________mol.
CuSO4+SO2↑+2H2O反应中,若有3.2g的Cu参与反应,则被还原的H2SO4的物质的量是________mol.
0.05
分析:在Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O反应中,浓硫酸表现为酸性和氧化性,当有2mol硫酸参加反应时,有1mol被还原,根据铜的质量可结合方程式计算.
CuSO4+SO2↑+2H2O反应中,浓硫酸表现为酸性和氧化性,当有2mol硫酸参加反应时,有1mol被还原,根据铜的质量可结合方程式计算.
解答:n(Cu)=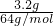 =0.05mol,
=0.05mol,
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O 被还原H2SO4
CuSO4+SO2↑+2H2O 被还原H2SO4
1mol 1mol
0.05mol n
n=0.05mol,
故答案为:0.05.
点评:本题考查氧化还原反应的计算,题目难度不大,可通过方程式计算,注意浓硫酸在反应中既表现为酸性,也表现出氧化性.
分析:在Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O反应中,浓硫酸表现为酸性和氧化性,当有2mol硫酸参加反应时,有1mol被还原,根据铜的质量可结合方程式计算.
CuSO4+SO2↑+2H2O反应中,浓硫酸表现为酸性和氧化性,当有2mol硫酸参加反应时,有1mol被还原,根据铜的质量可结合方程式计算.解答:n(Cu)=
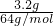 =0.05mol,
=0.05mol,Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O 被还原H2SO4
CuSO4+SO2↑+2H2O 被还原H2SO41mol 1mol
0.05mol n
n=0.05mol,
故答案为:0.05.
点评:本题考查氧化还原反应的计算,题目难度不大,可通过方程式计算,注意浓硫酸在反应中既表现为酸性,也表现出氧化性.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目