题目内容
下列实验对应的离子方程式正确的是( )
| A、铝溶解在NaOH溶液中:2Al+2OH-=2AlO2-+3H2↑ |
| B、醋酸溶液滴入NaHCO3溶液中:H++HCO3-=CO2↑+H2O |
| C、SO2通入溴水中:SO2+Br2+H2O=SO42-+2Br-+2H+ |
| D、少量铁溶于过量稀硝酸中:Fe+4H++NO3-=Fe3++NO↑+2H2O |
考点:离子方程式的书写
专题:
分析:A.离子方程式两边氢元素质量不相等;
B.醋酸为弱酸,离子方程式中醋酸不能拆开;
C.离子方程式两边电荷、质量不守恒;
D.稀硝酸过量,反应生成硝酸铁、一氧化氮气体和水.
B.醋酸为弱酸,离子方程式中醋酸不能拆开;
C.离子方程式两边电荷、质量不守恒;
D.稀硝酸过量,反应生成硝酸铁、一氧化氮气体和水.
解答:
解:A.铝溶解在NaOH溶液中,反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,故A错误;
B.醋酸溶液滴入NaHCO3溶液中,醋酸需要保留分子式,正确的离子方程式为:CH3COOH+HCO3-=CO2↑+H2O+CH3COO-,故B错误;
C.SO2通入溴水中,反应生成硫酸和溴化氢,正确的离子方程式为:SO2+Br2+2H2O=SO42-+2Br-+4H+,故C错误;
D.少量铁溶于过量稀硝酸中,反应生成硝酸铁、NO气体和水,反应的离子方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O,故D正确;
故选D.
B.醋酸溶液滴入NaHCO3溶液中,醋酸需要保留分子式,正确的离子方程式为:CH3COOH+HCO3-=CO2↑+H2O+CH3COO-,故B错误;
C.SO2通入溴水中,反应生成硫酸和溴化氢,正确的离子方程式为:SO2+Br2+2H2O=SO42-+2Br-+4H+,故C错误;
D.少量铁溶于过量稀硝酸中,反应生成硝酸铁、NO气体和水,反应的离子方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O,故D正确;
故选D.
点评:本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
下列变化中,能表明硝酸具有氧化性的是( )
| A、石蕊试剂变红色 |
| B、能跟Ag反应生成AgNO3 |
| C、碳酸钙反应 |
| D、能和FeO反应生成Fe(NO3)3 |
下列说法错误的是( )
| A、不同条件下,1mol任何气体所含分子个数均相同 |
| B、1mol任何气体的体积均为22.4L |
| C、1mol气体在压强一定时,50℃时体积比20℃时体积大 |
| D、1LO2和1LO3在同温同压下具有相同数目的分子 |
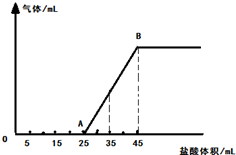 将一定量的NaOH、NaHCO3和Na2CO3三种溶液混合,向混合液中逐渐滴滴加一定浓度的稀盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示:
将一定量的NaOH、NaHCO3和Na2CO3三种溶液混合,向混合液中逐渐滴滴加一定浓度的稀盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示: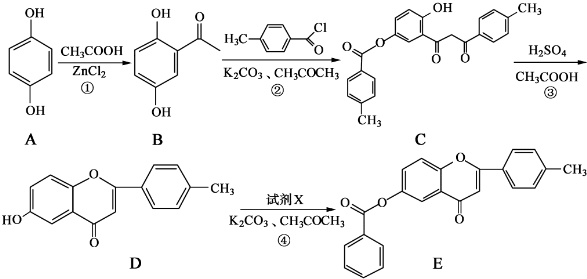

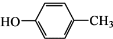 和CH3COOH为原料制备
和CH3COOH为原料制备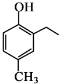 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题: