题目内容
通过对实验现象的观察、分析推理得出正确的结论,这是化学学习的方法之一.对下列实验事实解释正确的是( )
| A、浓HNO3在光照条件下变黄浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
| B、K I淀粉溶液中通入适量Cl2,溶液变蓝Cl2能与淀粉发生显色反应 |
| C、向某溶液中加硝酸酸化的氯化钡溶液,有白色沉淀生成说明该溶液中含有SO42- |
| D、向盐酸中加入浓硫酸时产生白雾说明浓硫酸具有脱水性 |
考点:硝酸的化学性质,氯气的化学性质,浓硫酸的性质,硫酸根离子的检验
专题:卤族元素,氧族元素,氮族元素
分析:A、浓硝酸不稳定分解生成的二氧化氮溶于硝酸,使硝酸呈黄色.
B、氯气氧化碘离子为碘单质,碘遇淀粉变蓝色.
C、某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,溶液可能含有Ag+或SO42-或SO32-.
D、浓硫酸具有吸水性,且稀释浓硫酸会放出大量热,氯化氢具有挥发性,温度越高,其挥发性越强.
B、氯气氧化碘离子为碘单质,碘遇淀粉变蓝色.
C、某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,溶液可能含有Ag+或SO42-或SO32-.
D、浓硫酸具有吸水性,且稀释浓硫酸会放出大量热,氯化氢具有挥发性,温度越高,其挥发性越强.
解答:
解:A、浓硝酸不稳定分解生成的二氧化氮溶于硝酸,使硝酸呈黄色,故A正确;
B、氯气氧化碘离子为碘单质,碘遇淀粉变蓝色,故B错误;
C、溶液含有Ag+或SO42-或SO32-,加入硝酸酸化的氯化钡溶液,会有白色沉淀生成,不能说明溶液含SO42-,故C错误;
D、浓硫酸具有吸水性,且稀释浓硫酸会放出大量热,氯化氢具有挥发性,温度越高,其挥发性越强,故D错误.
故选:A.
B、氯气氧化碘离子为碘单质,碘遇淀粉变蓝色,故B错误;
C、溶液含有Ag+或SO42-或SO32-,加入硝酸酸化的氯化钡溶液,会有白色沉淀生成,不能说明溶液含SO42-,故C错误;
D、浓硫酸具有吸水性,且稀释浓硫酸会放出大量热,氯化氢具有挥发性,温度越高,其挥发性越强,故D错误.
故选:A.
点评:考查元素化合物的性质,难度不大,注意C选项中干扰离子的影响.

练习册系列答案
相关题目
 25℃时,在20ml 0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )
25℃时,在20ml 0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )| A、在A点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、在B点:c(Na+)=c(CH3COO-),c(OH-)=c(H+) |
| C、在C点:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| D、在C点:c(Na+)=c(CH3COO-)+c(CH3COOH) |
中药狼把草的成分之一M具有消炎杀菌作用,M的结构如下所示:下列叙述正确的是( )


| A、M的相对分子质量是180 |
| B、1 mol M最多能与5 mol Br2发生反应 |
| C、M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
| D、1 mol M与足量NaHCO3反应能生成2 mol CO2 |
HPE是合成除草剂的重要中间体,其结构简式如图所示:下列有关HPE的说法正确的是( )
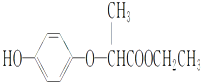

| A、1 mol HPE最多可以和2 mol NaOH反应 |
| B、HPE不能跟浓溴水反应 |
| C、HPE在1H核磁共振谱中有8种峰 |
| D、该物质不能发生在加成反应 |
下列关于有机物的正确说法是( )
| A、乙烯和乙烷可发生加成反应 |
| B、淀粉、油脂、蛋白质都能水解,但水解产物相同 |
| C、苯只能发生取代反应,不能发生加成反应 |
| D、乙醇、乙酸都能发生取代反应 |
 已知分子式为C12H12的物质A结构简式为如图:已知A的环上的二溴代物有9种同分异构物,由此推断A的环上的四溴代物的异构体的数目有( )
已知分子式为C12H12的物质A结构简式为如图:已知A的环上的二溴代物有9种同分异构物,由此推断A的环上的四溴代物的异构体的数目有( )| A、9种 | B、10种 |
| C、11种 | D、2种 |
常温下,下列各组离子在指定环境下能大量共存的是( )
| A、pH=1的溶液中:Na+、K+、SO32-、MnO4- |
| B、pH=7的溶液中:Na+、Al3+、Cl-、CO32- |
| C、pH>12的溶液中:Na+、K+、SO42-、AlO2- |
| D、pH=0的溶液中:Na+、I-、NO3-、ClO- |
短周期主族元素X、Y、Z中,X与Y的原子核外电子层数相同,X的原子半径大于Y,Xm+与Zn+具有相同的电子层结构.下列叙述一定正确的是( )
| A、Y是非金属元素 |
| B、若m>n,则Xm+的半径大于Zn+的半径 |
| C、X、Y、Z 三种元素位于元素周期表中的不同周期 |
D、若X、Y形成化合物的电子式是 ,则原子序数Y>Z>X ,则原子序数Y>Z>X |