题目内容
2.实验室中用下列装置制FeCl3,可供选择的试剂有:①MnO2 ②NaOH溶液 ③饱和NaCl溶液 ④浓硫酸 ⑤浓盐酸.
(1)按气体流向由左到右排列,各装置的连接顺序为(填写A~E序号):
A接E接C接B接D.
(2)实验开始时先点燃A处酒精灯,点燃B处酒精灯前必须观察到的现象是黄绿色气体充满玻璃管.
(3)A装置烧瓶中反应的方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2OC中所放试剂是浓硫酸.
(4)停止反应后,还有Fe丝剩余.为检验FeCl3生成,并最终得到FeCl3溶液,某学生设计以下实验步骤:
a.待B装置玻璃管冷却后,将管中物质用水溶解,过滤除去不溶物;
b.取少量滤液,滴加KSCN溶液,检验Fe3+;
c.取少量滤液,滴加硝酸酸化的AgNO3溶液,检验Cl-
请指出该实验步骤中可能存在的不足,说明理由和改进方法(写出相应的离子反应方程式):溶解物质时发生反应Fe+2Fe3+=3Fe2+,溶质可能为FeCl2或FeCl2和FeCl3的混合溶液,在检验氯离子后需要向溶液中通入Cl2,2Fe2++Cl2=2Fe3++2Cl-.
分析 (1)实验室中用下列装置制FeCl3,利用装置A制备氯气,得到氯气中含有水蒸气和氯化氢,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,干燥的氯气通过装置B和铁反应生成氯化铁,剩余氯气通过装置D吸收,防止污染空气;
(2)点燃B处酒精灯前需要理由氯气赶净装置中的空气,氯气应充满B中的玻璃管;
(3)A中选择:①MnO2 ⑤浓盐酸,加热反应生成氯化锰=氯气和水;装置C是吸收氯气中的水蒸气,用浓硫酸吸收;
(4)铁和氯化铁反应生成氯化亚铁,溶液可能为氯化亚铁或氯化亚铁和氯化铁的混合物,加入KSCN溶液变红色检验铁离子存在,取少量滤液,滴加硝酸酸化的AgNO3溶液,检验Cl-存在,为得到氯化铁溶液,需要最后通入氯气氧化亚铁离子为铁离子,得到氯化铁溶液.
解答 解:(1)实验室中用下列装置制FeCl3,利用装置A制备氯气,得到氯气中含有水蒸气和氯化氢,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,干燥的氯气通过装置B和铁反应生成氯化铁,剩余氯气通过装置D吸收,防止污染空气,装置连接顺序为:AECBD,
故答案为:A;E;C;B;D;
(2)点燃B处酒精灯前需要理由氯气赶净装置中的空气,氯气应充满B中的玻璃管,实验开始时先点燃A处酒精灯,点燃B处酒精灯前必须观察到的现象是黄绿色气体充满玻璃管,
故答案为:黄绿色气体充满玻璃管;
(3)A中选择:①MnO2 ⑤浓盐酸,加热反应生成氯化锰、氯气和水反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,装置C是吸收氯气中的水蒸气,用浓硫酸吸收,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;浓硫酸;
(4)停止反应后,还有Fe丝剩余,待B装置玻璃管冷却后,将管中物质用水溶解,过滤除去不溶物,铁和氯化铁反应生成氯化亚铁,溶液可能为氯化亚铁或氯化亚铁和氯化铁的混合物,加入KSCN溶液变红色检验铁离子存在,取少量滤液,滴加硝酸酸化的AgNO3溶液,检验Cl-存在,为得到氯化铁溶液,需要最后通入氯气氧化亚铁离子为铁离子,得到氯化铁溶液,
故答案为:溶解物质时发生反应Fe+2Fe3+=3Fe2+,溶质可能为FeCl2或FeCl2和FeCl3的混合溶液,在检验氯离子后需要向溶液中通入Cl2,2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查了实验室制备氯气的反应原理,杂质除杂,物质的制备注意问题和尾气吸收方法,装置连接顺序是解题关键,题目难度中等.

 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定错误的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定错误的是( )| A. | Al2H6在固态时所形成的晶体是分子晶体 | |
| B. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 | |
| C. | Al2H6中含有离子键和极性共价键 | |
| D. | Al2H6在空气中完全燃烧,产物为氧化铝和水 |
| A. | 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸 | |
| B. | CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物 | |
| C. | 酸酐只含两种元素,一种为氧元素,另一种可以为金属或非金属元素,例如CO2、Mn2O7 | |
| D. | 在熔化状态下能导电的化合物为离子化合物 |

有关物质沸点数据
| 物质 | 沸点 |
| 乙醚 | 34.6℃ |
| 乙醇 | 78.2℃ |
①Ⅰ和Ⅱ是反应发生装置,应该选择Ⅰ(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连.
②乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是防止乙醇挥发.
③Ⅲ中水冷凝管的进水口是b(选答“a”或“b”).冰盐水的作用是凝液化乙醚.
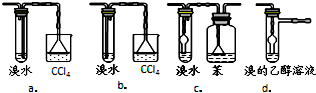
④有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险.该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)c、d.
⑤反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色.写出实验过程中有气体生成的化学方程式(写两个方程式)CH3CH2OH+6H2SO4$\stackrel{△}{→}$2CO2↑+6SO2↑+↑+2H2O;C+2H2SO4$\stackrel{△}{→}$CO2↑+2SO2↑+2H2O、CH3CH2OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O、CH3CH2OH+2H2SO4$\stackrel{△}{→}$2C+2SO2↑+5H2O(其中两个).
⑥实验中收集到的乙醚产品中可能含有多种杂质.某同学设计了以下提纯方案:

(2)分液步骤除去产品中的酸性杂质,则X可以是NaOH.
(3)蒸馏操作可除去的杂质是乙醇(CH3CH2OH).
| A. | 溶质的质量分数是25% | |
| B. | 溶质的物质的量浓度是1.10 mol•L-1 | |
| C. | 溶质和溶剂的物质的量之比是1:50 | |
| D. | 硫酸根离子的质量分数是9.60% |

| A. | 反应前后分子种类不发生改变 | |
| B. | 反应前后原子的种类与数目发生改变 | |
| C. | 反应前两种分子的个数比是1:2 | |
| D. | 该反应的基本类型是化合反应 |



 ,请回答下列问题:
,请回答下列问题: