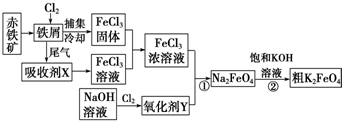
题目内容
8.为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验.(1)若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L.反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑;样品中铝的质量为$\frac{9b}{11.2}$g.
(2)若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3氧化铁与铝的质量比是80:27若1mol氧化铁参与反应,转移的电子数为6mol
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c:b=2:3.
分析 (1)氧化铁和氢氧化钠溶液不反应,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,结合反应计算;
(2)铝与氧化铁在高温下生成铁与氧化铝,据此写出反应的化学方程式;
(3)由方程式可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,注意铁与盐酸反应生成氯化亚铁.
解答 解:(1)氧化铁和氢氧化钠溶液不反应,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,测得生成的气体(标准状况,下同)体积为b L,则Al的质量为$\frac{bL}{22.4L/mol}$×$\frac{2}{3}$×27g/mol=$\frac{9b}{11.2}$g,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;$\frac{9b}{11.2}$;
(2)铝与氧化铁在高温下生成铁与氧化铝,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,氧化铁与铝的质量比是160:27×2=80:27,若1mol氧化铁参与反应,转移的电子数为1mol×2×(3-0)=6mol,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;80:27;6;
(3)由方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3可知,(2)中生成的铁的物质的量n(Fe)等于铝热剂中铝的物质的量n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,所以(3)中生成的氢气与(1)中生成氢气体积之比c:b=2n(Fe):3n(Al)=2:3,
故答案为:2:3.
点评 本题考查氧化还原反应的计算,为高频考点,把握物质的性质、发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意转移电子的计算,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )| A | B | C | D | |
| X | CO2 | HCl | NaOH | AlCl3 |
| Y | Ca(OH)2 | Na[Al(OH)4] | AlCl3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
①放出的气体中除SO2外还有H2;
②反应结束时转移的电子的总物质的量为4mol;
③只放出SO2气体,其物质的量为1mol;
④反应结束后加入KNO3固体Zn粉继续溶解.
| A. | 只有① | B. | 只有② | C. | 只有③ | D. | 只有②③④ |
| A. | 甲为氯化钡 | B. | 乙溶液含有Cl- | ||
| C. | 丙溶液含有 SO42- | D. | 丁溶液含有NH4+ |
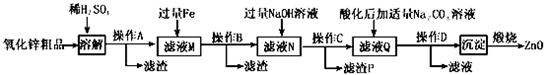
已知:Zn(OH)2可溶于NaOH溶液.一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
(2)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是增大固液接触面积,加快溶解时的反应速率.
(3)加入过量铁可回收的金属是Cu.
(4)常温下若向滤液N中加入适量的H2O2溶液,再加一定量某试剂调节溶液pH=5,则Fe3+浓度为4.0×10-7mol/L(已知Ksp[Fe(OH)3]=4.0×10-34)
(5)用K3[Fe(CN)6](铁氰化钾)验证N中Fe2+的现象是有蓝色沉淀生成.
(6)“沉淀”的成分为ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,煅烧获得ZnO的反应的化学方程式为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(7)取20.00mL.滤渡N,用0.02mol/L的KMnO4溶液进行滴定,消耗KMnO4溶液18.00mL,则滤液N中Fe2+的浓度为0.09mol/L.
| A. | CH3COOH | B. | CH3COOCH2CH3 | C. | CH2=CHCOOH | D. | 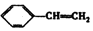 |