题目内容
3.将标况下的2.24LCO2通入150mL 1mol•L-1NaOH溶液中,溶液中离子浓度由小到大的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).分析 标准状况下2.24LCO2的物质的量为0.1mol,150mL 1mol/LNaOH溶液中含有0.15molNaOH,二者恰好发生反应2CO2+3NaOH=Na2CO3+NaHCO3+H2O,反应后生成了等浓度的碳酸钠和碳酸氢钠,然后结合盐的水解原理判断各离子浓度大小.
解答 解:标准状况下,2.24LCO2的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,
150mL 1mol/LNaOH溶液中含有0.15molNaOH,二者发生反应2CO2+3NaOH=Na2CO3+NaHCO3+H2O生成等浓度的Na2CO3、NaHCO3,
HCO3-、CO32-部分水解,溶液呈碱性,则c(OH-)>c(H+),
由于CO32-水解程度大于HCO3-,则c(HCO3-)>c(CO32-),
所以反应后溶液中的离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握盐的水解原理及其影响,要求学生能够根据电荷守恒、盐的水解原理等知识判断溶液中离子浓度大小.

练习册系列答案
相关题目
14.晶体硅是一种重要的非金属材料,工业上用碳在高温下还原石英砂(主要成份为含铁、铝等杂质的二氧化硅)得粗硅,粗硅与氛气在450-500℃条件下反应生成四氯化硅,四氯化硅经提纯后与过量H2在1100℃-1200℃条件下反应制得高纯硅.以下是实验室制备SiCl4的装置示意图.

实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4,A1C13,FeCl3遇水均易水解,有关物质的物理常数见下表:
请回答下列问题:
(1)实验室制备氯气有以下五步操作,其正确操作顺序为④③⑤②①(填标号).
①向烧瓶中装入二氧化锰固体,向分液漏斗中加入浓盐酸
②检查装置的气密性
③把酒精灯放在铁架台上,根据酒精灯火焰确定铁圈高度,固定铁圈,放上石棉
④在烧瓶上装好分液漏斗,安装好导气管
⑤将烧瓶固定在铁架台上
(2)装置A的硬质玻璃管中发生主要反应的化方程式是2C+SiO2+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO↑.装置A.B间导管短且粗的原因是防止生成物中的AlCl3、FeCl3等杂质凝结成固体堵塞导管;验中尾气处理的方法是连接一个加热的装有CuO粉末的反应管.
(3)装置B中e瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氛化硅.在精馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(4)装置D中的Na2SO3的作用主要是吸收未反应完的Cl2请设计一个实验,证明装置D中的Na2SO3已被氧化(简述实验步骤):取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化.
(5)SiCl4极易水解,其完全水解的产物为H4SiO4(或H2SiO3)和HCl.H2还原SiCl4制得高纯硅的过程中若混入O2,可能引起的后果是可能引起爆炸;硅被氧化得不到高纯硅.

实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4,A1C13,FeCl3遇水均易水解,有关物质的物理常数见下表:
| 物质 | SiC14 | A1C13 | FeC13 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
(1)实验室制备氯气有以下五步操作,其正确操作顺序为④③⑤②①(填标号).
①向烧瓶中装入二氧化锰固体,向分液漏斗中加入浓盐酸
②检查装置的气密性
③把酒精灯放在铁架台上,根据酒精灯火焰确定铁圈高度,固定铁圈,放上石棉
④在烧瓶上装好分液漏斗,安装好导气管
⑤将烧瓶固定在铁架台上
(2)装置A的硬质玻璃管中发生主要反应的化方程式是2C+SiO2+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO↑.装置A.B间导管短且粗的原因是防止生成物中的AlCl3、FeCl3等杂质凝结成固体堵塞导管;验中尾气处理的方法是连接一个加热的装有CuO粉末的反应管.
(3)装置B中e瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氛化硅.在精馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(4)装置D中的Na2SO3的作用主要是吸收未反应完的Cl2请设计一个实验,证明装置D中的Na2SO3已被氧化(简述实验步骤):取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化.
(5)SiCl4极易水解,其完全水解的产物为H4SiO4(或H2SiO3)和HCl.H2还原SiCl4制得高纯硅的过程中若混入O2,可能引起的后果是可能引起爆炸;硅被氧化得不到高纯硅.
18.根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷水)=Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W做电极组成的原电池,电极反应为W2++2e-=W,Y-2e-=Y2+.可知X、Y、W、Z的还原性由强到弱的顺序是( )
| A. | X>Z>Y>W | B. | Z>W>X>Y | C. | Z>X>Y>W | D. | Z>Y>X>W |
8.下列物质性质与应用对应关系正确的是( )
| A. | 晶体硅熔点高硬度大,可用于制作半导体材料 | |
| B. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| C. | 二氧化硫具有氧化性,可用于漂白纸浆 | |
| D. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用作净水剂 |
15. 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列说法不正确的是
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列说法不正确的是
( )
 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列说法不正确的是
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列说法不正确的是( )
| A. | 普伐他汀分子中有4种含氧官能团 | |
| B. | 每个普伐他汀分子中含有13个手性碳原子 | |
| C. | 在一定条件下,普伐他汀能发生加成、取代、消去、缩聚反应 | |
| D. | 普伐他汀可以和NaOH溶液、Na2CO3溶液反应,还可以和酸性KMnO4溶液反应 |
12.某反应过程能量变化如图所示,下列说法正确的是( )
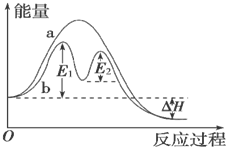

| A. | 反应过程a有催化剂参与 | |
| B. | 该反应为放热反应,热效应等于△H | |
| C. | 改变催化剂,不能改变该反应的活化能 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
13.用1000g溶剂中所含溶质的物质的量来表示的溶液浓度叫做质量物质的量浓度,其单位是mol/kg.5mol/kg的硫酸的密度是1.29g/cm3,则其物质的量浓度是( )
| A. | 3.56mol/L | B. | 5.23mol/L | C. | 5.00mol/L | D. | 4.33mol/L |