题目内容
7.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 配制500mL 4.6mol/L的稀硫酸需取该硫酸125mL | |
| C. | 1mol Cu与足量的该硫酸反应产生2g氢气 | |
| D. | 等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2mol/L |
分析 A.根据c=$\frac{1000ρω}{M}$计算该硫酸溶液的物质的量浓度;
B.根据溶液稀释前后溶质的物质的量不变分析;
C.铜与浓硫酸加热反应生成二氧化硫,不会生成氢气;
D.硫酸的浓度越小密度越小,该硫酸与等质量的水混合所得溶液质量为原硫酸溶液的2倍,密度小于原硫酸溶液,故混合后溶液的体积大于原硫酸溶液的2倍,稀释后溶质硫酸不变,据此进行判断.
解答 解:A.该硫酸溶液的物质的量浓度为:$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故A错误;
B.设配制500mL4.6mol•L-1的稀硫酸需取该硫酸的体积为xL,配制的溶液为500mL 4.6mol/L的稀硫酸,根据溶液稀释前后溶质的物质的量不变可知:0.5L×4.6mol/L=x×18.4mol/L,解得:x=0.125L=125mL,故B正确;
C.铜在浓硫酸中加热反应生成的是SO2,不生成氢气,故C错误;
D.硫酸的浓度越小密度越小,该硫酸与等质量的水混合所得溶液质量为原硫酸溶液的2倍,密度小于原硫酸溶液,故混合后溶液的体积大于原硫酸溶液的2倍,稀释后溶质硫酸不变,所得溶液的物质的量浓度小于9.2mol/L,故D错误;
故选B.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度与溶质质量分数的关系为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 在一个确定的化学反应中,反应物的总能量总是高于生成物的总能量 |
15.下列变化是通过取代反应来实现的是( )
| A. | CH3CH2OH→CH3COOCH2CH3 | B. | CH2=CH2→CH3-CH2Br | ||
| C. | CH2=CH2+H2O $\stackrel{催化剂}{→}$ CH3CH2OH | D. |  → → |
17.在化学反应中,反应前与反应后相比较,肯定不变的是( )
①元素的种类 ②原子的种类 ③分子数目 ④原子数目 ⑤反应前后物质的总质量⑥反应前后反应体系的总能量.
①元素的种类 ②原子的种类 ③分子数目 ④原子数目 ⑤反应前后物质的总质量⑥反应前后反应体系的总能量.
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ①②④⑤ | D. | ②③⑤⑥ |
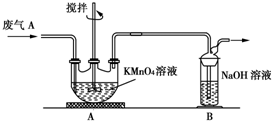 ①为了保证实验成功,装置A应具有的现象是KMnO4溶液的紫红色不能完全褪色,搅拌的目的是提高SO2的吸收率.
①为了保证实验成功,装置A应具有的现象是KMnO4溶液的紫红色不能完全褪色,搅拌的目的是提高SO2的吸收率.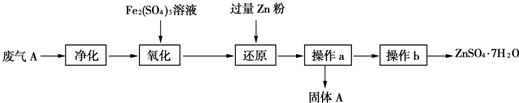

 .
.