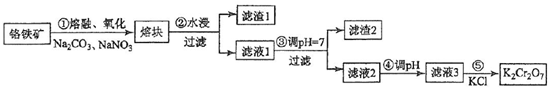
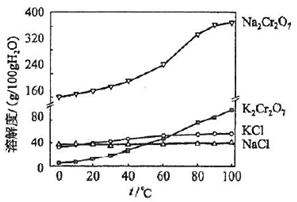
题目内容
7.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 3.4g H2O2中含有的共用电子对数为0.1NA | |
| B. | 25℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA | |
| C. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA | |
| D. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA |
分析 A、求出双氧水的物质的量,然后根据双氧水中含3对共用电子对来分析;
B、溶液体积不明确;
C、求出混合气体的物质的量,然后根据甲烷和乙烯中均含4个H原子来分析;
D、氯气和水的反应为可逆反应.
解答 解:A、3.4g双氧水的物质的量为0.1mol,而双氧水中含3对共用电子对,故0.1mol双氧水中含0.3NA对共用电子对,故A错误;
B、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故B错误;
C、标况下11.2L混合气体的物质的量为0.5mol,而甲烷和乙烯中均含4个H原子,故0.5mol混合气体中含2molH原子即2NA个,故C正确;
D、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
3.下列离子方程式正确的是( )
| A. | 向Na[Al(OH)4]溶液中通入足量CO2:2[Al(OH)4]-+CO2═2Al(OH)3↓+CO32-+H2O | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2Na++2OH-═Na2SiO3+H2O | |
| C. | 铜和氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 碳酸钡和稀硝酸反应:CO32-+2H+═CO2↑+H2O |
18.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 14g 分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| B. | Na2O2与H2O的反应中每生成0.1molO2,转移电子数目为0.4NA | |
| C. | 常温常压下,1.7g NH3所含电子数为0.8NA | |
| D. | 标准状况下,11.2L NO与11.2LO2混合,原子总数小于2NA |
2.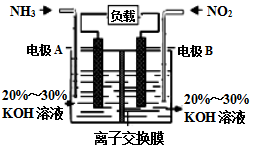 2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一.
2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574.0KJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160.0KJ•mol-1
③H2O(g)═H2O(l)△H=-44.0KJ•mol-1
则:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-955.0kJ•mol-1.
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
①下列说法不能作为判断该反应达到化学平衡状态标志的是BC
A.活性炭的质量 B.v正(N2)=2v逆(NO)
C.容器内压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变
②在T0C时,该反应的平衡常数为0.56(小数点后保留两位有效数字);
③在50min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原
来的两倍,则化学平衡正向移动(填“正向移动”、“逆向移动”或“不移动”)
(3)利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.
①A电极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
②下列关于该电池的说法正确的是B.
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一断时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol.
 2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一.
2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一.(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574.0KJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160.0KJ•mol-1
③H2O(g)═H2O(l)△H=-44.0KJ•mol-1
则:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-955.0kJ•mol-1.
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
物质 浓度(mol/L) 时间(min) | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
A.活性炭的质量 B.v正(N2)=2v逆(NO)
C.容器内压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变
②在T0C时,该反应的平衡常数为0.56(小数点后保留两位有效数字);
③在50min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原
来的两倍,则化学平衡正向移动(填“正向移动”、“逆向移动”或“不移动”)
(3)利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.
①A电极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
②下列关于该电池的说法正确的是B.
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一断时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol.
12.背景材料:
①“神舟六号”的防护层由聚四氟乙烯和玻璃纤维布组合而成;
②光化学烟雾是导致珠三角地区空气质量下降的重要原因;
③近期,某市举行“液氯泄漏”预警演习;
④据湖北省环境质最监测所抽査显示,新装修住房甲醛含量7成超标.
⑤在广东、香港海域,渤海湾均出现过大面积的赤潮.据此判断,下列说法正确的是
(1)“神舟六号”的防护层是复合材料,四氟乙烯属于不饱和烃.
(2)光化学污染主要是由氮氧化物和碳氢化物引起的.
(3)发生“液氯泄漏”时,应疏导群众立即逆风向高处远离出事地点
(4)为降低甲醛含量,新装修住房应紧闭门窗,并放置一盆水
(5)赤潮是指在一定条件下海洋中某些生物短时间内大量繁殖或聚集,使海水变红色、褐色的现象( )
①“神舟六号”的防护层由聚四氟乙烯和玻璃纤维布组合而成;
②光化学烟雾是导致珠三角地区空气质量下降的重要原因;
③近期,某市举行“液氯泄漏”预警演习;
④据湖北省环境质最监测所抽査显示,新装修住房甲醛含量7成超标.
⑤在广东、香港海域,渤海湾均出现过大面积的赤潮.据此判断,下列说法正确的是
(1)“神舟六号”的防护层是复合材料,四氟乙烯属于不饱和烃.
(2)光化学污染主要是由氮氧化物和碳氢化物引起的.
(3)发生“液氯泄漏”时,应疏导群众立即逆风向高处远离出事地点
(4)为降低甲醛含量,新装修住房应紧闭门窗,并放置一盆水
(5)赤潮是指在一定条件下海洋中某些生物短时间内大量繁殖或聚集,使海水变红色、褐色的现象( )
| A. | (1)(2)(3) | B. | (1)(2)(5) | C. | (2)(3)(5) | D. | (2)(4)(5) |
19.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 12.0gNaHSO4晶体中阳离子数为0.2NA个 | |
| B. | 0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L | |
| C. | T℃时,1L pH=6的纯水中,含1×10-6NA个H+ | |
| D. | 标准状况下,1 L pH=13的NaOH溶液中OH-为0.1NA个 |
16.由下列实验及现象不能推出相应结论的是( )
| 实验 | 现象 | 结论 | |
| A. | 向2 mL 0.1FeCl 3的溶液中加足量铁粉,震荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| B. | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
| C. | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| D. | 向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
 现有X、Y、Z、W、R、T六种短周期主族元素,它们的原子序数依次增大,W与R同主族,且W的氢化物常温时为液态.X、Y的最外层电子数之和与Z的最外层电子数相等,X分别与Y、Z、W形成电子总数相等的分子.
现有X、Y、Z、W、R、T六种短周期主族元素,它们的原子序数依次增大,W与R同主族,且W的氢化物常温时为液态.X、Y的最外层电子数之和与Z的最外层电子数相等,X分别与Y、Z、W形成电子总数相等的分子.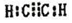 (写电子式).该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为C2H2-10e-+4H2O=2CO2+10H+.
(写电子式).该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为C2H2-10e-+4H2O=2CO2+10H+.