题目内容
8.下列各方程式中,属于水解反应的是( )| A. | CO2+H2O?H2CO3 | B. | OH-+HS-?S2-+H2O | ||
| C. | HS-+H2O?H3O++S2- | D. | S2-+H2?HS-+OH- |
分析 根据盐类水解的定义:盐电离出的弱酸或弱碱离子与水电离产生的氢离子或氢氧根离子结合生成弱电解质的反应,以此来解答.
解答 解:A.CO2+H2O?H2CO3是CO2与水反应生成碳酸,不属于水解反应,故A错误;
B.HS-+H2O?H3O++S2-是HS-的电离方程式,不属于水解反应,故B错误;
C.HS-+H2O?H3O++S2-是HS-与碱反应的离子方程式,不是水解方程式,故C错误;
D.S2-+H2?HS-+OH-是S2-与水电离出来的氢离子结合生成HS-,属于水解反应,故D正确;
故选D.
点评 本题考查盐类水解原理、水解离子方程式的分析判断,注意电离方程式的理解应用,要特别注意电离方程式与水解方程式的辨别,题目难度不大.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
3.下列说法正确的是( )
| A. | 常温下,反应C(s)+H2O(g)═CO(g)+H2(g)不能自发进行,则该反应的△H>0 | |
| B. | 一定温度下,反应MgCl2(l)═Mg(l)+Cl2(g)的△H>0,△S<0 | |
| C. | 放热的自发过程,一定是熵增加的过程 | |
| D. | 液态水可自发挥发成水蒸气的过程是熵减的过程 |
17.NA为阿伏伽德罗常数,下列物质所含分子数最少的是( )
| A. | 标准状况下4.48L的二氧化碳 | |
| B. | 3.2g氧气(氧气的摩尔质量为32g.mol-1) | |
| C. | 含0.4NA个分子的氢气 | |
| D. | 0.5mol氮气 |
18.下列有机物属于有机高分子化合物的是( )(1)酒精(2)葡萄糖 (3)淀粉(4)蛋白质.
| A. | (1)(2) | B. | (3)(4) | C. | (1)(3) | D. | (2)(4) |
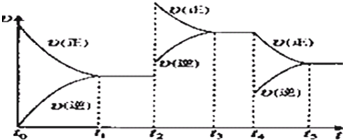
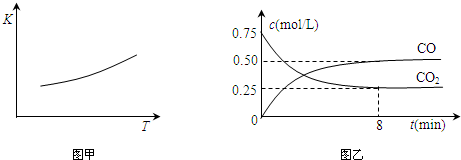
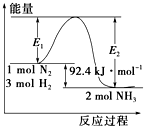 合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.
合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.