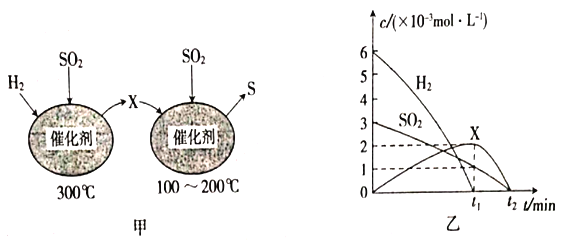
题目内容
【题目】已知烯烃经臭氧氧化后,在Zn存在下水解,可得到醛和一种有机物酮,如:
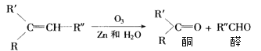
现有化学式C7H14的烯烃,与H2完全加成后的产物,核磁共振氢谱有三组峰,且峰面积之比为9:6:1,满足条件的烯烃经O3氧化后,在Zn存在下水解的产物共可能有几种(不考虑立体异构)( )
A. 2种B. 4种C. 5种D. 6种
【答案】C
【解析】
化学式C7H14的烯烃,与H2完全加成后的产物,核磁共振氢谱有三组峰,峰面积之比为9:6:1,则生成的烷烃可为CH(CH2CH3)3、C(CH3)3CH(CH3)2,对应的烯烃可为CH2=CHCH(CH2CH3)2或CH3CH=C(CH2CH3)2,和C(CH3)3C(CH3)=CH2,经臭氧氧化后,在Zn存在下水解的产物有5种。
故答案选C。

练习册系列答案
相关题目