题目内容
(1)相同质量的CO和CO2,它们所含的分子数之比为 ,所含的原子数之比为 ,在同温同压下,它们的密度之比为 .
(2)有五种物质是①6gH2 ②0.1molCO2 ③1.204×1024个HCl分子 ④147g硫酸 ⑤92g乙醇(C2H6O),它们的物质的量最大的是 (填序号,下同),所含分子数最多的是 ,含有原子数最多的是 ,质量最大的是 .
(2)有五种物质是①6gH2 ②0.1molCO2 ③1.204×1024个HCl分子 ④147g硫酸 ⑤92g乙醇(C2H6O),它们的物质的量最大的是
考点:物质的量的相关计算
专题:计算题
分析:(1)令CO和CO2的质量都是1g,根据n=
计算各自物质的量,分子数目之比等于其物质的量之比;每个CO分子含有2个原子,原子物质的量为CO的2倍,每个CO2分子含有3个原子,含有原子物质的量为二氧化碳的3倍;相同条件下,密度之比等于其相对分子质量之比;
(2)先根据物质的量与其它物理量之间的转化关系,将选项中的各量转化成物质的量,根据N=n×NA可知物质的量越大,含有的分子数越多;原子的物质的量越大,含有的原子数越多,再根据m=n×M进行计算.
| m |
| M |
(2)先根据物质的量与其它物理量之间的转化关系,将选项中的各量转化成物质的量,根据N=n×NA可知物质的量越大,含有的分子数越多;原子的物质的量越大,含有的原子数越多,再根据m=n×M进行计算.
解答:
解:(1)令CO和CO2的质量都是1g,CO的物质的量=
=
mol,CO2的物质的量=
=
mol,
根CO和CO2分子数目之比=
mol:
mol=11:7;
每个CO分子含有2个原子,原子物质的量为CO的2倍,每个CO2分子含有3个原子,含有原子物质的量为二氧化碳的3倍,故CO和CO2含有原子数目之比=11×2:7×3=22:21;
相同条件下,密度之比等于其相对分子质量之比,故CO和CO2的密度之比=28:44=7:11;
故答案为:11:7;22:21;7:11;
(2)①6gH2的物质的量为:
=3mol,n(原子)=3×2=6mol,m=6g,
②0.1molCO2的物质的量为:0.1mol,n(原子)=0.1×3=0.3mol,m=0.1×44=4.4g,
③1.204×1024个HCl的物质的量为:2mol,n(原子)=2×2=4mol,m=2×36.5=73g,
④147gH2SO4的物质的量为:
=1.5mol,n(原子)=1.5×7=10.5mol,m=147g,
⑤92g乙醇(CH3CH2OH)的物质的量为:
=2mol,n(原子)=2×9=18mol,m=92g;
因此:物质的量最大的是①,故含有分子数最多的就是①,原子的物质的量最大的是⑤,故含有原子数最多的就是⑤,质量最大的是④,
故答案为:①;①;⑤;④.
| 1g |
| 28g/mol |
| 1 |
| 28 |
| 1g |
| 44g/mol |
| 1 |
| 44 |
根CO和CO2分子数目之比=
| 1 |
| 28 |
| 1 |
| 44 |
每个CO分子含有2个原子,原子物质的量为CO的2倍,每个CO2分子含有3个原子,含有原子物质的量为二氧化碳的3倍,故CO和CO2含有原子数目之比=11×2:7×3=22:21;
相同条件下,密度之比等于其相对分子质量之比,故CO和CO2的密度之比=28:44=7:11;
故答案为:11:7;22:21;7:11;
(2)①6gH2的物质的量为:
| 6g |
| 2g/mol |
②0.1molCO2的物质的量为:0.1mol,n(原子)=0.1×3=0.3mol,m=0.1×44=4.4g,
③1.204×1024个HCl的物质的量为:2mol,n(原子)=2×2=4mol,m=2×36.5=73g,
④147gH2SO4的物质的量为:
| 147g |
| 98g/mol |
⑤92g乙醇(CH3CH2OH)的物质的量为:
| 92g |
| 46g/mol |
因此:物质的量最大的是①,故含有分子数最多的就是①,原子的物质的量最大的是⑤,故含有原子数最多的就是⑤,质量最大的是④,
故答案为:①;①;⑤;④.
点评:本题考查物质的量有关计算、微粒数目计算、阿伏伽德罗定律及其推论,明确基本公式是解本题关键,注意根据PV=nRT理解阿伏伽德罗定律及其推论,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
若ag某气体中含有的分子数为b,则cg该气体的物质的量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列说法正确的是( )
| A、用新制氢氧化铜检验牙膏中的甘油,现象是看到有蓝色沉淀 |
| B、皮肤不慎接触溴液,应先用苯或甘油洗皮肤再用水洗;吸入氯气、氯化氢气体时,可以吸入少量酒精或乙醚的混合蒸气解毒 |
| C、颗粒太小的沉淀或胶状沉淀不宜用减压过滤,过滤的溶液有强氧化性、强碱性或强酸性时,不能用玻璃纤维代替滤纸,应使用玻璃砂漏斗代替布氏漏斗 |
| D、检验火柴头中的氯元素,可将火柴头浸泡在蒸馏水中一会儿,取少量溶液于试管中,加入AgNO3、NaNO3及稀硝酸,观察是否有白色沉淀生成 |
下列说法与盐的水解无关的是( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,溶液时往往在FeCl3溶液中加入少量的盐酸;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤将FeCl3溶液蒸干并灼烧,得到的固体是Fe2O3;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,溶液时往往在FeCl3溶液中加入少量的盐酸;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤将FeCl3溶液蒸干并灼烧,得到的固体是Fe2O3;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
| A、①③⑥ | B、②③⑤ |
| C、③④⑤ | D、全有关 |
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A、1 mol碳正离子(CH+3)所含的电子总数为8NA | ||
| B、1 mol甲基(-CH3)所含的电子总数为9NA | ||
| C、0.5 摩1,3-丁二烯分子中含有C=C双键数为 NA | ||
D、标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为
|
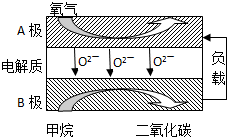 甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.
甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.