题目内容
9.原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子.请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为
 .
.(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是HF>HI>HBr>HCl
(填化学式),呈现如此递变规律的原因是HF分子之间形成氢键,使其熔沸点较高,HI、HBr、HCl分子之间只有范德华力,相对分子质量越大,范德华力越大,沸点越高.
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为sp2,另一种的晶胞如图二所示,该晶胞的空间利用率为34%(保留两位有效数字).($\sqrt{3}$=1.732)

(4)D元素形成的单质,其晶体的堆积模型为面心立方最密堆积,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是①②③(填选项序号).
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液.请写出上述过程的离子方程式Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O.
分析 原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,则A为氢元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为碳元素;D的基态原子的最外能层只有一个电子,其他能层均已充满电子,D原子外围电子排布为3d104s1,则D为铜元素;结合原子序数可知,C只能处于第三周期,B与C可形成正四面体型分子,则B为氯元素.
(1)四种元素中电负性最大的是Cl,其基态原子的价电子排布为3s23p5;
(2)HF分子间存在氢键,沸点最高,其它卤化氢随着相对分子质量递增,其沸点升高;
(3)图一为平面结构,在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化;
根据均摊法计算晶胞中C原子数目,令碳原子直径为a,计算晶胞中C原子总体积,碳原子与周围的4个原子形成正四面体结构,中心碳原子与正四面体顶点原子相邻,中心碳原子到底面距离为$\frac{a}{3}$,则正四面体的高为(a+$\frac{a}{3}$),设正四面体的棱长为x,则斜面的高为$\frac{\sqrt{3}}{2}$x,底面中心到边的距离为为$\frac{\sqrt{3}}{2}$x×$\frac{1}{3}$,再根据勾股定理计算x与a的关系,晶胞棱长=2x×$\frac{\sqrt{2}}{2}$=$\sqrt{2}$x,再计算晶胞体积,晶胞空间利用率=$\frac{原子总体积}{晶胞体积}$×100%;
(4)晶体Cu为面心立方最密堆积,结合图三醋酸铜晶体的局部结构可确定其晶体中含有极性键、非极性键和配位键;
(5)硫酸铜溶液中加入氨水会产生氢氧化铜蓝色沉淀,继续滴加氨水,沉淀溶解,得到四氨合铜络离子,溶液为深蓝色的透明溶液.
解答 解:原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,则A为氢元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为碳元素;D的基态原子的最外能层只有一个电子,其他能层均已充满电子,D原子外围电子排布为3d104s1,则D为铜元素;结合原子序数可知,C只能处于第三周期,B与C可形成正四面体型分子,则B为氯元素,
(1)四种元素中电负性最大的是Cl,其基态原子的价电子排布为3s23p5,其基态原子的价电子排布图为 ,
,
故答案为: ;
;
(2)HF分子之间形成氢键,使其熔沸点较高,HI、HBr、HCl分子之间只有范德华力,相对分子质量越大,范德华力越大,沸点越高,即沸点由高到低的顺序是HF>HI>HBr>HCl,
故答案为:HF>HI>HBr>HCl;HF分子之间形成氢键,使其熔沸点较高,HI、HBr、HCl分子之间只有范德华力,相对分子质量越大,范德华力越大,沸点越高;
(3)图一为平面结构,在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化;
一个晶胞中含碳原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,令碳原子直径为a,晶胞中C原子总体积=8×$\frac{4}{3}$π($\frac{a}{2}$)3,碳原子与周围的4个原子形成正四面体结构,中心碳原子与正四面体顶点原子相邻,中心碳原子到底面距离为$\frac{a}{3}$,则正四面体的高为(a+$\frac{a}{3}$)=$\frac{4a}{3}$,设正四面体的棱长为x,则斜面的高为$\frac{\sqrt{3}}{2}$x,底面中心到边的距离为$\frac{\sqrt{3}}{2}$x×$\frac{1}{3}$,再根据勾股定理:($\frac{4a}{3}$)2+($\frac{\sqrt{3}}{2}$x×$\frac{1}{3}$)2=($\frac{\sqrt{3}}{2}$x)2,整理得x=$\frac{2\sqrt{6}}{3}$a,故晶胞棱长=$\frac{2\sqrt{6}}{3}$a×$\sqrt{2}$=$\frac{4\sqrt{3}}{3}$a,则晶胞体积为($\frac{4\sqrt{3}}{3}$a)3,晶胞空间利用率={[8×$\frac{4}{3}$π($\frac{a}{2}$)3]÷($\frac{4\sqrt{3}}{3}$a)3}×100%≈34%,
故答案为:sp2;34%;
(4)晶体Cu为面心立方最密堆积,结合图三醋酸铜晶体的局部结构可确定其晶体中含有极性键、非极性键和配位键,
故答案为:面心立方最密堆积;①②③;
(5)硫酸铜溶液中加入氨水会产生蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,有关反应的离子方程式为Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O,
故答案为:首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液;Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O.
点评 本题是对物质结构的考查,题目综合性较大,涉及元素推断、核外电子排布、晶体结构与化学键、杂化轨道、配合物、晶胞计算等,是对学生综合能力的考查,(3)中计算为易错点、难度,需要学生具备一定的空间想象与数学计算能力,难度中等.

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案①Cu ②食盐 ③蔗糖 ④CO2 ⑤BaSO4 ⑥KNO3.
| A. | ④⑤ | B. | ④⑤ | C. | ②⑥ | D. | ⑤⑥ |
| A. | 乙烯的结构简式CH2CH2 | B. | 聚丙烯的结构简式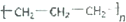 | ||
| C. | 羟基的结构简式 | D. | 3-甲基-1-丁烯的键线式 |
| 物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) | 水中溶解性 |
| 甲 | C3H6O2 | -98 | 47.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 87 | 0.90 | 可溶 |
| A. | 萃取法 | B. | 升华法 | C. | 蒸馏法 | D. | 分液法 |
| A. | 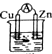 乙醇 | B. |  稀H2SO4 | C. |  稀HCl | D. |  稀H2SO4 |

| A. | 甲装置中电能转化为化学能 | |
| B. | 两个装置中铜片表面均有气泡产生 | |
| C. | 甲装置中铜片表面发生了还原反应 | |
| D. | 甲装置中负极上发生的电极反应为Fe-3e-═Fe3+ |
| A. | 原子半径:W>X>Y>Z | |
| B. | 单质与盐酸反应速率:Y>W | |
| C. | X最低价氢化物的稳定性强于Z最低价氢化物 | |
| D. | 原子序数:X>W>Y>Z |

 原电池是化学能转化为电能的装置.在如图所示的原电池工作过程中,电子流出的极是Zn(填电极材料的元素符号)电极;SO42-迁移流向的极是Zn(填电极材料的元素符号)电极;正极的电极反应式是Cu2++2e-=Cu;若原电池工作一段时间后,消耗6.5g锌,则外电路转移的电子数目为0.2NA.
原电池是化学能转化为电能的装置.在如图所示的原电池工作过程中,电子流出的极是Zn(填电极材料的元素符号)电极;SO42-迁移流向的极是Zn(填电极材料的元素符号)电极;正极的电极反应式是Cu2++2e-=Cu;若原电池工作一段时间后,消耗6.5g锌,则外电路转移的电子数目为0.2NA.