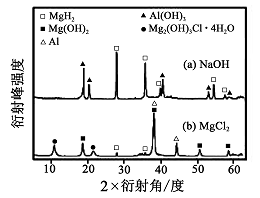
题目内容
某科研小组以难溶性钾长石(K2O?Al2O3?6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下: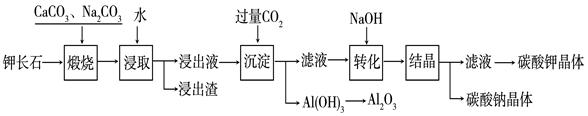
(1)煅烧过程中钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式是: 。
(2)已知NaAlO2和KAlO2易发生如下水解反应:AlO2—+ 2H2O  Al(OH)3 + OH— ,“浸取”时应保持溶液呈 性(填“酸”或“碱”)。
Al(OH)3 + OH— ,“浸取”时应保持溶液呈 性(填“酸”或“碱”)。
(3)“转化”时加入NaOH的主要作用是 (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是 、 和水。
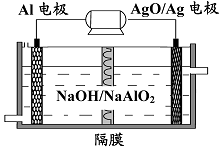
(5)以Al2O3为原料,以石墨为电极,通过电解法可制得金属铝。电解池中接电源负极的一极的电极反应式是 。长时间电解后,需要更换新的石墨电极的是 极(填“阴”或“阳”)。
(14分)(1)Na2CO3+Al2O3 2NaAlO2+CO2↑ (2分) (2)碱 (2分);
2NaAlO2+CO2↑ (2分) (2)碱 (2分);
(3)HCO3- + OH-=H2O + CO32- (2分)
(4)Na2CO3、CO2(不分先后,每个2分) (5)Al3++ 3e-=Al (2分) 阳 (2分)
解析试题分析:(1)根据原子守恒可知,氧化铝和碳酸钠在高温下反应生成偏铝酸钠的同时,一定还有二氧化碳产生,所以反应化学方程式为Na2CO3+Al2O3 2NaAlO2+CO2↑。
2NaAlO2+CO2↑。
(2)偏铝酸根离子水解呈碱性,所以要抑制其水解,“浸取”时应在碱性条件下进行。
(3)由工艺流程可知,滤液中主要含有碳酸氢钾、碳酸氢钠,“转化”时加入NaOH,将碳酸氢钾、碳酸氢钠转化为碳酸钾、碳酸钠,反应离子反应方程式为HCO3- + OH-=H2O + CO32-。
(4)煅烧时需要碳酸钠,在流程图提取碳酸钾之前可得到碳酸钠,所以碳酸钠是可以参与可循环利用的物质。在浸出液中需通二氧化碳,而碳酸钙与二氧化硅、氧化铝和碳酸钠在高温下反应都有二氧化碳生成,所以二氧化碳也是可以参与循环使用的物质。
(5)电解池中连接电源负极的电极为阴极,阴极得到电子,发生还原反应。所以铝离子在阴极放电生成Al,电极反应式为Al3++ 3e-=Al。电极过程中阳极生成氧气,生成的氧气会和碳反应生成二氧化碳,阳极石墨被消耗,因此需要更换新的石墨电极的是阳极。
考点:考查方程式的书写、铝及其化合物的性质、反应条件的可知、原料的利用、电化学原理的应用和电极反应式的书写等

(1)向FeCl3溶液中加入a g的铜粉,搅拌使之全部溶解,溶液中一定有的阳离子是_________。可能有的阳离子是 。发生反应的离子方程式为 ;再向其中加入 b g铁粉,充分反应后过滤得滤渣c g,可能发生反应的离子方程式为 。若已知 a>b>c,则 c克滤渣是_________。
(2)鉴别Na2SO3溶液和稀H2SO4。请按要求完成下表:
| 步骤 | 操作 | 现象及结论 |
| 1 | 用甲、乙两支试管分别取两种溶液各少许。 | |
| 2 | 用胶头滴管向甲试管中逐滴滴加BaCl2溶液至过量。 | |
| 3 | 。 | ,则甲是 ,乙是 。 ,则甲是 ,乙是 。 |
说明:第3步不能使用其他任何仪器(包括胶头滴管)和试剂。
(16分)铜与浓硫酸反应,实验装置如图所示。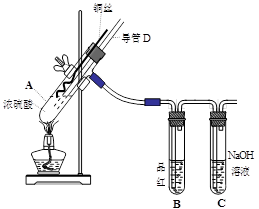
(1) 装置A中发生反应的化学方程式为: ,反应过程中试管B中的现象是 ,试管C的作用是 。
(2) 导管D的下端(虚线段)应位于 (液面上、液面下),导管D的作用有:①实验结束后排除装置中的SO2;② 。
实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有CuO、Cu2O、CuS、Cu2S。为探究甲的成分,进行了以下的实验。
查阅资料可知:Cu2O + 2HCl =CuCl2+ Cu + H2O, 2Cu2O + O2煅烧 4CuO,2CuS+3O2煅烧2CuO+2SO2,Cu2S+2O2煅烧2CuO+SO2。CuS、 Cu2S和稀HCl不反应。
|
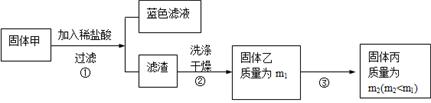 (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。
(3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。(4) 煅烧过程中,除上述反应外,还可能发生反应的方程式为 。
(5)结论:甲中有CuO,还肯定含有的物质是 。
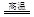 6Cu+SO2
6Cu+SO2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。