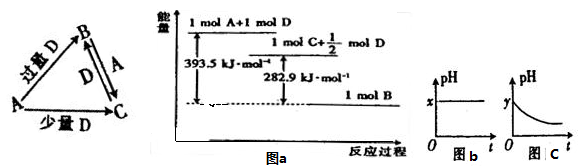
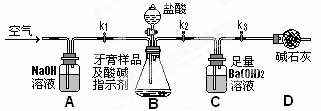
题目内容
(1)向FeCl3溶液中加入a g的铜粉,搅拌使之全部溶解,溶液中一定有的阳离子是_________。可能有的阳离子是 。发生反应的离子方程式为 ;再向其中加入 b g铁粉,充分反应后过滤得滤渣c g,可能发生反应的离子方程式为 。若已知 a>b>c,则 c克滤渣是_________。
(2)鉴别Na2SO3溶液和稀H2SO4。请按要求完成下表:
| 步骤 | 操作 | 现象及结论 |
| 1 | 用甲、乙两支试管分别取两种溶液各少许。 | |
| 2 | 用胶头滴管向甲试管中逐滴滴加BaCl2溶液至过量。 | |
| 3 | 。 | ,则甲是 ,乙是 。 ,则甲是 ,乙是 。 |
说明:第3步不能使用其他任何仪器(包括胶头滴管)和试剂。
(12分)
(1)Fe2+、Cu2+ Fe3+ Cu+2Fe3+=2Fe2++Cu2+
2Fe3+ + Fe= 3Fe2+ 、 Fe+ Cu2+= Fe2+ + Cu Cu
(2)将乙试管中溶液逐渐倒入甲试管,边加边振荡 有气泡产生 Na2SO3溶液 稀H2SO4 先无气泡产生,后来有刺激性气味气体放出 稀H2SO4 Na2SO3溶液
解析试题分析:(1)氯化铁溶液能氧化铜,为了使之完全溶解,氯化铁溶液可能过量;由于Cu+2Fe3+=2Fe2++Cu2+,则溶解铜后的溶液中一定含有的金属阳离子为Fe2+、Cu2+,可能有的是Fe3+;由于氧化性:Fe3+ >Cu2+>Fe2+,则加入一定量的铁粉时,先发生的反应为2Fe3+ + Fe= 3Fe2+,铁离子被还原后,过量的铁粉还能再发生反应Fe+ Cu2+= Fe2+ + Cu,由于a>b>c,说明最终溶液中金属阳离子一定含有Fe2+、Cu2+,因此滤渣中肯定没有Fe,只有Cu;(2)、若步骤2甲的试管中反应式为Na2SO3+BaCl2=BaSO3↓+2NaCl或、H2SO4+BaCl2=BaSO4↓+2HCl,第3步不能使用其它任何仪器和试剂,只能将乙试管中溶液逐渐倒入甲试管,若沉淀不溶解,但有气泡产生,则甲是Na2SO3溶液,乙是稀H2SO4;若先无气泡,后有气泡产生,则甲是稀H2SO4,乙是Na2SO3溶液;因为BaSO3与稀H2SO4混合立即反应,生成硫酸钡沉淀、SO2和H2O,而稀HCl与少量的Na2SO3反应时无明显现象,生成NaHSO3,与足量的Na2SO3溶液反应时生成SO2。
考点:考查Fe3+的氧化性、Cu的还原性、氧化还原反应的先后、物质推断、物质检验方案的设计、离子方程式的书写等相关知识。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案铝及其化合物在生产生活中具有重要的作用。
(1)铝在元素周期表中的位置是 。
(2)已知电负性的数值表示原子对电子吸引能力的相对大小。以下是几种原子的电负性数值:
| 元素 | 钠 | 镁 | 铝 | 硅 |
| 电负性 | 0.9 | 1.2 | χ | 1.8 |
①铝的电负性χ的范围是 。
②电负性的数值与元素金属性的关系是 。
③下列实验能比较镁和铝的金属性强弱的是 。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al(s)+3O2(g)=2Al2O3(s) ΔH1=-3352 kJ/mol
Mn(s)+O2(g)=MnO2(s) ΔH2= -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是 。
(4)冶炼金属铝时,用石墨做电极电解熔融Al2O3。液态铝在(填“阴”或“阳”) 极得到,电解过程中,阳极石墨需要不断补充,结合电极反应说明其原因是 。
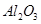 ,含
,含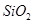 、
、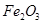 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下: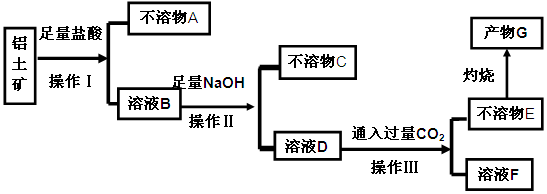
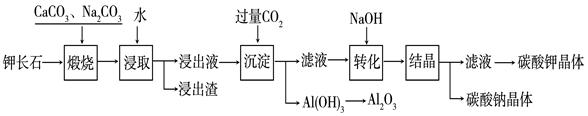
 Al(OH)3 + OH— ,“浸取”时应保持溶液呈 性(填“酸”或“碱”)。
Al(OH)3 + OH— ,“浸取”时应保持溶液呈 性(填“酸”或“碱”)。