题目内容
下列反应中属于加成反应的是( )
| A、乙烯通入溴水使之褪色 |
| B、乙烯使酸性高锰酸钾溶液褪色 |
| C、四氯化碳与溴水混合振荡,静置后溴水褪色 |
| D、在催化剂作用下生成聚乙烯 |
考点:取代反应与加成反应
专题:有机反应
分析:有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应,结合物质的结构判断.
解答:
解:A.乙烯通入溴水使之褪色,乙烯中碳碳双键中的1个碳碳键断裂,每个碳原子上结合一个溴原子生成1,2-二溴乙烷,所以属于加成反应,故A正确;
B.乙烯使酸性高锰酸钾溶液褪色,是高锰酸钾和乙烯发生了氧化反应的结果,故B错误;
C.四氯化碳与溴水混合振荡,静置后溴水褪色,是由于四氯化碳萃取了溴水中的溴,不是加成反应,故C错误;
D.在催化剂作用下生成聚乙烯,属于加聚反应,故D错误;
故选A.
B.乙烯使酸性高锰酸钾溶液褪色,是高锰酸钾和乙烯发生了氧化反应的结果,故B错误;
C.四氯化碳与溴水混合振荡,静置后溴水褪色,是由于四氯化碳萃取了溴水中的溴,不是加成反应,故C错误;
D.在催化剂作用下生成聚乙烯,属于加聚反应,故D错误;
故选A.
点评:本题主要考查了加成反应的判断,加成反应的条件是有机物中必须含有不饱和键(如碳碳双键、碳碳三键等).

练习册系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、氨气通入醋酸溶液CH3COOH+NH3═CH3COONH4 |
| B、金属钠跟水反应Na+H2O═Na++OH-+H2↑ |
| C、碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ |
| D、澄清的石灰水跟盐酸反应H++OH-═H2O |
下列叙述中,正确的是( )
| A、在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 |
| B、得电子越多的氧化剂,其氧化性就越强 |
| C、反应前各原子的物质的量之和一定等于反应后各原子的物质的量之和 |
| D、溶液稀释前溶质的物质的量一定等于溶液稀释后溶质的物质的量 |
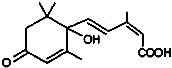 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开,S-诱抗素的 分子结构如图,下列关于该分子的说法中正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开,S-诱抗素的 分子结构如图,下列关于该分子的说法中正确的是( )| A、含有碳碳双键、羟基、羰基、羧基 |
| B、能发生加成反应、氧化反应、取代反应、缩聚反应 |
| C、1mol该分子能与含2mol NaOH的溶液完全反应 |
| D、该分子能与溴水反应而使溴水褪色且1mol它能与溴水中的4mol Br2反应 |
将NaOH(固)、P2O5(固)、CaCl2(无水)归为一类,下列选项中能与这三种物质归为一类的是( )
| A、浓硫酸 | B、NaCl |
| C、碱石灰 | D、CaO |
工业上常用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路板,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.取上述反应后溶液20mL进行分析,测得其中c(Fe3+)为1mol/L,向其中加入足量的AgNO3溶液,生成沉淀 17.22g.则上述反应后20mL溶液中c(Cu2+)为( )
| A、0.5 mol/L |
| B、1mol/L |
| C、1.5 mol/L |
| D、2mol/L |
根据以下4个反应,确定Br-、I-、H2S、SO2的还原性由强到弱的顺序是( )
①H2S+I2=S↓+2I-+2H+ ②SO2+2H2S=3S+2H2O
③2I-+Br2=I2+2Br- ④SO2+I2+2H2O=H2SO4+2HI.
①H2S+I2=S↓+2I-+2H+ ②SO2+2H2S=3S+2H2O
③2I-+Br2=I2+2Br- ④SO2+I2+2H2O=H2SO4+2HI.
| A、H2S>SO2>I->Br- |
| B、I->Br->SO2>H2S |
| C、H2S>I->Br->SO2 |
| D、I->Br->H2S>SO2 |
下列离子方程式正确的是( )
| A、醋酸溶解水垢(主要成分是碳酸钙)CaCO3+2H+→CO2↑+Ca2++H2O | ||
| B、高级脂肪酸与氢氧化钠溶液反应:H++OH-=H2O | ||
| C、苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | ||
D、乙醛与银氨溶液的反应:CH3CHO+2[Ag(NH3)2]++2OH-
|
 硼、碳、硅元素的单质及其化合物的构成自然界的重要物质.请回答下列问题:
硼、碳、硅元素的单质及其化合物的构成自然界的重要物质.请回答下列问题: