题目内容
在下列用途或反应中,硫酸表现出的性质为:
A.高沸点性;B.酸性;C.吸水性;D.脱水性;E.强氧化性.试用字母填空:
(1)实验室制取氢气: .
(2)浓硫酸可用钢瓶贮运: .
(3)将浓硫酸加到盐酸中产生白雾: .
(4)实验室制取HCI气体: .
(5)浓硫酸可使湿润的蓝色石蕊试纸先变红,后变黑: .
A.高沸点性;B.酸性;C.吸水性;D.脱水性;E.强氧化性.试用字母填空:
(1)实验室制取氢气:
(2)浓硫酸可用钢瓶贮运:
(3)将浓硫酸加到盐酸中产生白雾:
(4)实验室制取HCI气体:
(5)浓硫酸可使湿润的蓝色石蕊试纸先变红,后变黑:
考点:浓硫酸的性质
专题:氧族元素
分析:(1)实验室制取氢气的实质是稀硫酸中的氢离子与金属反应;
(2)浓硫酸具有强的氧化性低温下能使铁铝发生钝化;
(3)盐酸具有挥发性,浓硫酸具有吸水性,吸收盐酸中的水,促进盐酸的挥发;
(4)浓硫酸难挥发,沸点高,盐酸易挥发沸点低;
(5)蓝色石蕊试纸变红说明硫酸具有酸性,变黑是因为浓硫酸具有脱水性.
(2)浓硫酸具有强的氧化性低温下能使铁铝发生钝化;
(3)盐酸具有挥发性,浓硫酸具有吸水性,吸收盐酸中的水,促进盐酸的挥发;
(4)浓硫酸难挥发,沸点高,盐酸易挥发沸点低;
(5)蓝色石蕊试纸变红说明硫酸具有酸性,变黑是因为浓硫酸具有脱水性.
解答:
解:(1)实验室制取氢气,实质是稀硫酸中的氢离子与金属反应,表现硫酸的酸性,故选:B;
(2)浓硫酸具有强的氧化性低温下能使铁铝发生钝化,所以可以用钢瓶贮运,故选:E;
(3)盐酸具有挥发性,浓硫酸具有吸水性,吸收盐酸中的水,促进盐酸的挥发,故选:C;
(4)浓硫酸难挥发,沸点高,盐酸易挥发沸点低,难挥发性酸制取易挥发性的酸,实验室制取HCI气体,体显浓硫酸的高沸点,故选:A;
(5)蓝色石蕊试纸变红说明硫酸具有酸性,变黑是因为浓硫酸具有脱水性,表现硫酸的酸性和脱水性,故选:BD.
(2)浓硫酸具有强的氧化性低温下能使铁铝发生钝化,所以可以用钢瓶贮运,故选:E;
(3)盐酸具有挥发性,浓硫酸具有吸水性,吸收盐酸中的水,促进盐酸的挥发,故选:C;
(4)浓硫酸难挥发,沸点高,盐酸易挥发沸点低,难挥发性酸制取易挥发性的酸,实验室制取HCI气体,体显浓硫酸的高沸点,故选:A;
(5)蓝色石蕊试纸变红说明硫酸具有酸性,变黑是因为浓硫酸具有脱水性,表现硫酸的酸性和脱水性,故选:BD.
点评:本题考查了硫酸的性质,题目难度不大,熟悉硫酸的性质是解题关键.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
下列物质均具有漂白作用,其中一种与另外三种的漂白原理不同的是( )
| A、SO2 |
| B、Na2O2 |
| C、O3 |
| D、新制氯水 |
把①蔗糖 ②麦芽糖 ③淀粉 ④纤维素 ⑤油脂 ⑥酶 ⑦蛋白质,在酸存在的条件下分别进行水解,其水解的最终产物只有1种的有( )
| A、①②③④⑤ | B、②③④ |
| C、④⑥⑦ | D、③④⑤⑥⑦ |
已知:
①1mol H2分子中化学键断裂时需要吸收436kJ的能量,
②1mol I2蒸气中化学键断裂时需要吸收151kJ的能量,
③由H原子和I原子形成1mol HI分子时释放299kJ的能量.
下列热化学方程式正确的是( )
①1mol H2分子中化学键断裂时需要吸收436kJ的能量,
②1mol I2蒸气中化学键断裂时需要吸收151kJ的能量,
③由H原子和I原子形成1mol HI分子时释放299kJ的能量.
下列热化学方程式正确的是( )
| A、2HI(g)=H2(g)+I2(g);△H=+11 kJ?mol-1 |
| B、H2(g)+I2(g)=HI(g);△H=-11 kJ?mol-1 |
| C、H2(g)+I2(g)=2HI(g);△H=+288 kJ?mol-1 |
| D、H2(g)+I2(g)=HI(g);△H=-114 kJ?mol-1 |
下列分子中含有两个π键的是( )
| A、O2 |
| B、N2 |
| C、H2O |
| D、C2H4 |
 在实验室进行工业合成氨的模拟实验:
在实验室进行工业合成氨的模拟实验: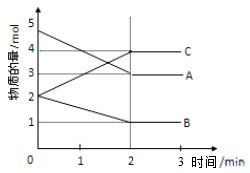 某温度时,在一恒容密闭容器中,A、B、C三种物质的物质的量n(mol)随时间t(min)变化的曲线如图所示,从图中的数据分析:
某温度时,在一恒容密闭容器中,A、B、C三种物质的物质的量n(mol)随时间t(min)变化的曲线如图所示,从图中的数据分析: