题目内容
16.下列有关化学反应过程或实验现象的叙述中,正确的是( )| A. | 氯气的水溶液可以导电,说明氯气是电解质 | |
| B. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| C. | 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 | |
| D. | 氯气、活性炭、SO2都能使品红溶液褪色,它们的漂白原理相同 |
分析 A、水溶液中或熔融状态导电的化合物为电解质分析判断;
B、漂白粉利用强氧化性消毒杀菌,明矾石利用铝离子水解生成的氢氧化铝胶体具有吸附杂质作用净水;
C、氯气无漂白性,起漂白性的是次氯酸;
D、氯气具有强氧化性,活性炭具有吸附性.
解答 解:A、电解质必须是化合物,氯气是单质,故A错误;
B、漂白粉是利用强氧化性消毒,而明矾净水是利用Al3+水解生成的Al(OH)3胶体吸附杂质,二者的作用原理是不相同,故B错误;
C、氯气可以使湿润的有色布条褪色,是因为Cl2+H2O=HClO+HCl,次氯酸具有漂白作用,氯气无漂白性,故C正确;
D、氯气具有强氧化性,与水反应生成具有漂白性的HClO,可使品红褪色,活性炭具有吸附性,二者原理不同,故D错误;
故选C.
点评 本题考查了氯气的性质分析判断,注意漂白性的物质判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
6.pH=2的醋酸溶液用水稀释10倍后的pH是( )
| A. | 0.2 | B. | 1 | C. | 3 | D. | 2~3 |
7.下列化学用语说法正确的是( )
| A. | 氮原子电子排布图为: | |
| B. | S2-的结构示意图: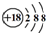 | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | 氯化钠的电子式: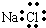 |
4.下列关于苯的叙述正确的是( )
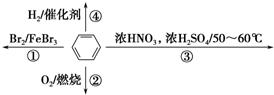

| A. | 反应①为取代反应,有机产物浮在上层 | |
| B. | 反应②为氧化反应,反应现象是火焰明亮并伴有浓烟 | |
| C. | 反应③为取代反应,只生成一种产物 | |
| D. | 反应④中1 mol苯最多与3 mol H2发生加成反应,因为苯分子含有3个碳碳双键 |
11.下列物质互为同位素的是( )
| A. | H和D | B. | O3和O2 | C. | CO和CO2 | D. | 金刚石和石墨 |
1.下列物质中所含分子物质的量最多的是( )
| A. | 44 g CO2 | B. | 1.5 mol H2 | ||
| C. | 标况下22.4L SO2 | D. | 3.01×1023个硫酸分子 |
8.下列各组中的物质在常温条件下能够相互反应的是( )
| A. | NH3、O2、NO2 | B. | N2、O2、H2 | C. | NO、O2、NH3 | D. | HBr、NH3、Cl2 |
5.设NA为阿佛加德罗常数,下列说法正确的是( )
| A. | 4.6g由NO2与N2O4组成的混合物中含有的N原子数为0.1NA | |
| B. | 40mL 10mol/L的浓HNO3与足量的Cu反应产生NO2分子数为0.2NA | |
| C. | 标准状况下,6.72LSO3中,含有的原子数目为0.3NA | |
| D. | 1L 0.1mol/L的氨水中含有的NH4+数目为0.1NA |
11.为了探索月球上是否有生命存在的痕迹,就要分析月球岩石中是否包藏有碳氢化合物(当然这仅仅是探索的第一步).科学家用氘盐酸(DCl)和重水(D2O)溶液处理月球岩石样品,对收集的气体加以分析,结果只发现有一些气体状态的碳氘化合物.这个实验不能用普通盐酸,其理由是( )
| A. | 普通盐酸的酸性太强 | |
| B. | 普通盐酸具有挥发性 | |
| C. | 普通盐酸和月球岩石中的碳化物无法反应 | |
| D. | 无法区别岩石中原来含有的是碳化物,还是碳氢化合物 |