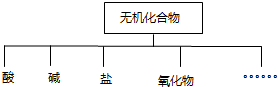
题目内容
现需5mol/L的盐酸200mL,下列方法一定可以实现的是( )
| A、将22.4 L HCl气体溶于水稀释至200 mL |
| B、将36.5 g HCl气体溶于200 mL水中 |
| C、取10 mol/L的盐酸100 mL加水100 mL |
| D、取10 mol/L的盐酸100 mL加水稀释至200 mL |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:A、无法计算出溶质的物质的量;
B、溶液的体积不等于溶剂的体积;
C、根据溶液的体积不能进行简单的加减;
D、根据根据溶液稀释前后溶质的物质的量不变,即C1V1=C2V2.
B、溶液的体积不等于溶剂的体积;
C、根据溶液的体积不能进行简单的加减;
D、根据根据溶液稀释前后溶质的物质的量不变,即C1V1=C2V2.
解答:
解:A、无法计算出22.4 L HCl的物质的量,所以无法计算出浓度,故A错误;
B、将36.5 g HCl气体溶于200 mL水中,溶液的体积不等于200 mL,所以无法计算出浓度,故B错误;
C、盐酸100 mL加水100 mL,溶液的体积不等于200mL,所以无法计算出浓度,故C错误;
D、溶液稀释前后溶质的物质的量不变,即C1V1=C2V2,可得10 mol/L×100 mL=c×200 mL,解得c=5mol/L,故D正确;
故选D.
B、将36.5 g HCl气体溶于200 mL水中,溶液的体积不等于200 mL,所以无法计算出浓度,故B错误;
C、盐酸100 mL加水100 mL,溶液的体积不等于200mL,所以无法计算出浓度,故C错误;
D、溶液稀释前后溶质的物质的量不变,即C1V1=C2V2,可得10 mol/L×100 mL=c×200 mL,解得c=5mol/L,故D正确;
故选D.
点评:本题考查了一定物质的量浓度溶液的配制,注意掌握物质的量浓度的概念及计算方法,明确溶液稀释后溶质物质的量浓度的计算方法,题目难度不大.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、4g 氦气中含有的分子数为NA |
| B、常温常压下,22.4 L Cl2中含有的分子数为NA |
| C、1 L 1 mol/L K2SO4溶液中含有的钾离子数为NA |
| D、1 mol钠原子中含有的电子数为NA |
下列离子方程式书写正确的是( )
| A、二氧化碳通入过量的氢氧化钠溶液:CO2+2 OH-=CO32-+H2O |
| B、碳酸钙与硝酸反应:CO32-+2H+=H2O+CO2↑ |
| C、少量金属钠放入冷水中:2Na+2H2O=2Na++2OH-+H2↑ |
| D、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
下列说法正确的是( )
| A、44 g CO2中含有2 mol C |
| B、O2的摩尔质量是32 g/mol |
| C、18 g H2O在标准状况下的体积是22.4 L |
| D、将58.5 g NaCl溶于1 L水中,所得溶液中NaCl的物质的量浓度为1 mol/L |
对下列有机反应类型的认识中,错误的是( )
A、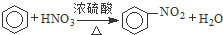 ;取代反应 ;取代反应 | ||
| B、CH2=CH2+Br2→CH2Br-CH2Br;加成反应 | ||
C、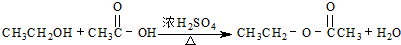 ;酯化反应 ;酯化反应 | ||
D、CH4+Cl2
|