题目内容
 如图所示,△H1=-393.5kJ?mol-1,△H2=-395.4kJ?mol-1,下列说法正确的是( )
如图所示,△H1=-393.5kJ?mol-1,△H2=-395.4kJ?mol-1,下列说法正确的是( )| A、C(s、石墨)═C(s、金刚石)△H=+1.9 kJ?mol-1 |
| B、石墨和金刚石的转化是物理变化 |
| C、金刚石的稳定性强于石墨 |
| D、1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:先根据图写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,根据物质的能量越低越稳定,拆化学键吸收能量,形成化学键放出热量来解答.
解答:
解:由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ?mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ?mol-1,则
A、因C(s、石墨)=C(s、金刚石)△H=+1.9kJ?mol-1,故A正确;
B、石墨转化为金刚石是发生的化学反应,属于化学变化,故B错误;
C、金刚石能量大于石墨的总能量,物质的能量越高越不稳定,则石墨比金刚石稳定,故C错误;
D、键能越大物质的能量越低,石墨的总键能比金刚石高,则1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ,故D正确;
故选:AD.
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ?mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ?mol-1,则
A、因C(s、石墨)=C(s、金刚石)△H=+1.9kJ?mol-1,故A正确;
B、石墨转化为金刚石是发生的化学反应,属于化学变化,故B错误;
C、金刚石能量大于石墨的总能量,物质的能量越高越不稳定,则石墨比金刚石稳定,故C错误;
D、键能越大物质的能量越低,石墨的总键能比金刚石高,则1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ,故D正确;
故选:AD.
点评:本题考查热利用盖斯定律的应用、物质的能量越低越稳定,题目难度不大,注意物质的稳定性与能量的关系.

练习册系列答案
相关题目
向某溶液中缓缓通入Cl2至过量,此过程中一直未观察到有沉淀生成,该溶液中可能大量共存的粒子组是( )
| A、Ag+、NO3-、Cu2+、Na+ |
| B、SO2、Ba2+、Cl-、K+ |
| C、CO32-、SO42-、K+、Na+ |
| D、AlO2-、Br-、Na+、NO3- |
将a气体通入BaCl2溶液中,没有沉淀生成,然后再通入b气体,有沉淀生成,则a、b不可能是( )
| A、a是Cl2,b是CO2 |
| B、a是SO2,b是H2S |
| C、a是NH3,b是CO2 |
| D、a是SO2,b是Cl2 |
2C(s)+O2(g)=2CO(g)△H=-221.0kJ?mol-1,这个热化学方程式表示( )
| A、2g碳燃烧生成一氧化碳时放出221.0kJ的热量 |
| B、2mol碳燃烧生成一氧化碳时吸收221.0kJ的热量 |
| C、2mol固体碳在氧气中燃烧生成2mol一氧化碳气体时放出221.0kJ的热量 |
| D、12g碳和氧气反应生成一氧化碳时放出221.0kJ的热量 |
下列物质的分离方法不正确的是( )
| A、用过滤的方法除去食盐中的泥沙 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、用酒精萃取碘水中的碘 |
| D、用分馏的方法从石油中提炼出汽油 |
下列说法正确的是( )
| A、酸性:HClO4<H2SO4<H3PO4 |
| B、稳定性:HF>HCl>HBr |
| C、原子半径:C>N>P |
| D、碱性:NaOH>KOH>Ca(OH)2 |
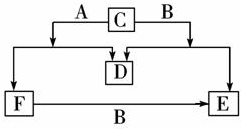 A、B、C、D、E、F六种物质中除D为气体单质外其余均为常见的化合物,E和F的水溶液均呈碱性,且都为重要的化工原料,其焰色反应为黄色,它们的转化关系如图所示.请回答下列问题:
A、B、C、D、E、F六种物质中除D为气体单质外其余均为常见的化合物,E和F的水溶液均呈碱性,且都为重要的化工原料,其焰色反应为黄色,它们的转化关系如图所示.请回答下列问题:

 )和双氧水为原料生产过氧化苯甲酰,写出该反应生成过氧化苯甲酰的化学反应方程式:
)和双氧水为原料生产过氧化苯甲酰,写出该反应生成过氧化苯甲酰的化学反应方程式: