题目内容
16. 氢气是一种理想的“绿色能源”,利用氢能需选择合适的储氢材料.目前正在研究和使用的储氢材料有镁系合金、稀土系合金等.
氢气是一种理想的“绿色能源”,利用氢能需选择合适的储氢材料.目前正在研究和使用的储氢材料有镁系合金、稀土系合金等.(1)铡镍合金在一定条件下可吸收氢气形成氢化物:LaNi3(s)+3H2(g)?LaNi5H6(s)△H<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是bc(选填字母编号).
a.增加LaNi5H6的量 b.升高温度 c.减小压强 d.使用催化剂
(2)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
 (g)$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$
(g)$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$ (g)+3H2(g)
(g)+3H2(g)①某温度下,向恒容密闭容器中加入环己烷,起始浓度为amol•L-1,平衡时苯的浓度为bmol•L-1,该反应的平衡常数K=$\frac{27b{\;}^{4}}{a-b}$mol3•L-3(用含a,b的代数式表示).
②一定条件下,如图装置可实现有机物的电化学储氢(忽略其它有机物).
A是电源的负极(填“正”或“负”);电极D上发生的电极反应为C6H6+6H++6e-=C6H12.
分析 (1)根据LaNi5(s)+3H2(g)?LaNi5H6(s)△H<0,欲使LaNi5H6 (s)释放出气态氢,则平衡向逆向移动,据此分析;
(2)①依据平衡常数表达式解答;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷.
解答 解:(1)欲使LaNi5H6 (s)释放出气态氢,则平衡向逆向移动,由LaNi5(s)+3H2(g)?LaNi5H6(s)△H<0为气体减小的放热反应,所以可以升高温度或降低压强,平衡向逆向移动;
故答案为:bc;
(4)①环己烷的起始浓度为amol•L-1,平衡时苯的浓度为bmol•L-1,同一容器中各物质反应的物质的量浓度之比等于其计量数之比,所以根据方程式知,环己烷的平衡浓度为(a-b)mol/L,氢气的浓度为3bmol/L,则平衡常数K=$\frac{C(C{\;}_{6}H{\;}_{6})C{\;}^{3}(H{\;}_{2})}{C(C{\;}_{6}H{\;}_{12})}$=$\frac{27b{\;}^{4}}{a-b}$mol3•L-3;
故答案为:$\frac{27b{\;}^{4}}{a-b}$mol3•L-3;
该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,电解池阴极与电源负极相连,得出电解过程中产生的气体F为O2,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,
故答案为:负;C6H6+6H++6e-=C6H12.
点评 本题考查了化学平衡及其电解池原理等知识点,题目难度较大,注意对相关知识的理解.

练习册系列答案
相关题目
6.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法正确的是( )
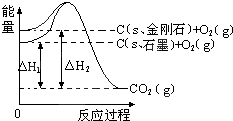

| A. | 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol-1 |
4.下列关于0.1mol/LNaHCO3溶液中微粒浓度的关系式正确的是( )
| A. | c(CO32-)>c(H2CO3) | B. | c(Na+)>c(HCO3-)>c(OH-)>c(H+) | ||
| C. | c(Na+)=2[c(H2CO3)+c(HCO3)+c(CO32-)] | D. | c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
1. 乙醇氧化制乙醛的实验装置如图所示(夹持仪器和加热仪器均未画出),下列叙述错误的是( )
乙醇氧化制乙醛的实验装置如图所示(夹持仪器和加热仪器均未画出),下列叙述错误的是( )
 乙醇氧化制乙醛的实验装置如图所示(夹持仪器和加热仪器均未画出),下列叙述错误的是( )
乙醇氧化制乙醛的实验装置如图所示(夹持仪器和加热仪器均未画出),下列叙述错误的是( )| A. | a中所盛的固体可以是CuO | |
| B. | d中乙醇可用沸水浴加热 | |
| C. | c处具支试管b中有无色液体产生 | |
| D. | c处具支试管b可换成带塞的普通试管 |
15.有机物①乙醇②乙酸③正丁烷④2-甲基丙烷,它们的沸点由高到低排列的顺序为( )
| A. | ③④②① | B. | ②①③④ | C. | ①③②④ | D. | ④③①② |

 请回答:
请回答: