题目内容
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+NOCl(g) K1 △H1<0 (Ⅰ)
NaNO3(s)+NOCl(g) K1 △H1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2NOCl(g) K2 △H2<0 (Ⅱ)
2NOCl(g) K2 △H2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=______(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=______(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1molCl2,10min时反应(Ⅱ)达到平衡。测得10min内v(NOCl)=7.5×10-3mol/(Lmin),则平衡后n(Cl2)=______ mol,NO的转化率α1=______。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2______α1(填“>”“<”或“=”),平衡常数K2_____(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是______。
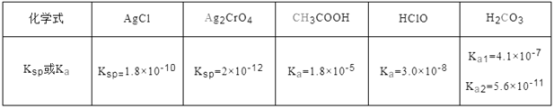
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为_________。(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L)。
(4)可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
【答案】![]() 0.025 75%
0.025 75% ![]()
![]() 升高温度 c(NO3-)>c(NO2-)>c(CH3COO-)
升高温度 c(NO3-)>c(NO2-)>c(CH3COO-) ![]()
【解析】
(1)依据化学平衡常数概念,结合反应化学方程式书写平衡常数,结合平衡常数表达式计算得到平衡常数关系;
(2)根据反应速率概念计算v=![]() 计算Cl2的平衡浓度,根据转化率概念的计算,转化率=
计算Cl2的平衡浓度,根据转化率概念的计算,转化率=![]() ×100%,计算NO的平衡转化率;反应(II)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2增大;平衡常数随温度变化,不随浓度、压强变化,若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行,平衡常数随温度变化;
×100%,计算NO的平衡转化率;反应(II)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2增大;平衡常数随温度变化,不随浓度、压强变化,若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行,平衡常数随温度变化;
(3)0.2mol NaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,由2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.1mol/L,NaNO2物质的量为0.1mol/L;
(4)HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L,说明CH3COOH酸性小于HNO2的酸性,溶液中醋酸根离子水解程度小于亚硝酸根离子水解程度,溶液B碱性大于A溶液。
(1)①2NO2(g)+NaCl(s)![]() NaNO3(s)+NOCl(g),△H1<0 (I),平衡常数K1=
NaNO3(s)+NOCl(g),△H1<0 (I),平衡常数K1=![]() ;
;
②2NO(g)+Cl2(g)![]() 2NOCl(g) △H2<0,平衡常数K2 =
2NOCl(g) △H2<0,平衡常数K2 =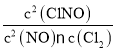 ;
;
③4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= ,计算得到K=
,计算得到K=![]() ;
;
(2)在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1molCl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10-3mol/(Lmin),其物质的量n(ClNO)= 7.5×10-3mol/(Lmin)×10min×2L=0.15mol,则根据物质反应转化关系可知反应消耗NO的物质的量为n(NO)=n(ClNO)=0.15mol,反应消耗Cl2的物质的量为n(Cl2)=![]() n(ClNO)=
n(ClNO)=![]() ×0.15mol= 0.075mol,所以平衡时氯气的物质的量n(Cl2)=0.mol-0.075mol=0.025mol;NO的转化率α1=
×0.15mol= 0.075mol,所以平衡时氯气的物质的量n(Cl2)=0.mol-0.075mol=0.025mol;NO的转化率α1=![]() ×100%=75%;其他条件保持不变,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2增大;平衡常数只与温度有关,不随浓度、压强变化,温度不变,化学平衡常数K2不变;若要使K2减小,平衡逆向进行,由于该反应的正反应是放热反应,根据平衡移动原理应升高温度,平衡逆向进行;
×100%=75%;其他条件保持不变,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2增大;平衡常数只与温度有关,不随浓度、压强变化,温度不变,化学平衡常数K2不变;若要使K2减小,平衡逆向进行,由于该反应的正反应是放热反应,根据平衡移动原理应升高温度,平衡逆向进行;
(3)0.2mol NaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,由2NO2+2NaOH=NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.1mol/L,NaNO2物质的量为0.1mol/L,溶液B为0.1mol/L的CH3COONa溶液;NaNO3是强酸强碱盐,不水解,c(NO3-)=0.1mol/L;CH3COOH、HNO2都是弱酸,HNO2的电离常数Ka=7.1×10-4molL-1,CH3COOH的电离常数Ka=1.7×10-5molL-1,说明CH3COOH酸性小于HNO2的酸性,溶液中醋酸根离子水解程度大于亚硝酸根离子水解程度,离子水解程度越大,溶液中离子浓度就越小,溶液B碱性大于A溶液,所以c(CH3COO-)<c(NO2-)<0.1mol/L,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-);
(4)欲使溶液A和溶液B的pH相等,
a.溶液B碱性大于A溶液,向溶液A中加适量水,稀释溶液,碱性减弱,不能调节使两个溶液pH相等,a错误;
b.向溶液A中加适量NaOH,增大碱性,可以调节溶液pH相等,b正确;
c.向溶液B中加适量水,稀释溶液碱性减弱,可以调节溶液pH相等,c正确;
d.溶液B碱性大于A溶液,向溶液B中加适量NaOH,B溶液pH更大,d错误;
故合理选项是bc。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案【题目】我国制碱工业的先驱——侯德榜先生发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O→NH4Cl+NaHCO3(晶体)。依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。

(1)A装置中所发生反应的离子方程式为___。C装置中稀硫酸的作用为___。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
温度 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析B装置中使用冰水的目的是___。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在___装置与___装置之间(填写字母)连接一个盛有___的洗气装置,其作用是___。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为___。