题目内容
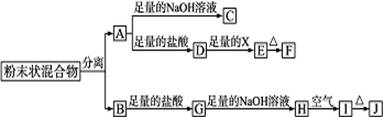
某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀.(此转化关系中所用的试剂都是足量的)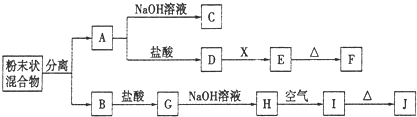
(1)写出下列物质的化学式:F
(2)将混合物中两种金属分离开的最简单的方法是
(3)D→E的转化中,加入的X是过量的,则X可以是
A.饱和NaCl溶液 B.Na2CO3溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:A→C:
J+A高温反应:
B在高温下与水蒸气的反应:

(1)写出下列物质的化学式:F
Al2O3
Al2O3
,GFeCl2
FeCl2
.(2)将混合物中两种金属分离开的最简单的方法是
用磁铁靠近粉末状混合物,将铁粉吸附在磁铁表面,与铝分离
用磁铁靠近粉末状混合物,将铁粉吸附在磁铁表面,与铝分离
.(3)D→E的转化中,加入的X是过量的,则X可以是
BC
BC
.A.饱和NaCl溶液 B.Na2CO3溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:A→C:
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
.J+A高温反应:
Fe2O3+2Al
2Fe+Al2O3
| ||
Fe2O3+2Al
2Fe+Al2O3
.
| ||
B在高温下与水蒸气的反应:
3Fe+4H2O(g)
4H2+Fe3O4
| ||
3Fe+4H2O(g)
4H2+Fe3O4
.
| ||
分析:I为红褐色沉淀,为Fe(OH)3,由转化关系可知,H为Fe(OH)2,G为FeCl2,B为Fe;
金属A能与盐酸、氢氧化钠溶液反应,A为金属Al;
E为白色沉淀,为Al(OH)3,
由转化关系可知,D为AlCl3,X为碱或水解为碱性的物质,F为Al2O3.
金属A能与盐酸、氢氧化钠溶液反应,A为金属Al;
E为白色沉淀,为Al(OH)3,
由转化关系可知,D为AlCl3,X为碱或水解为碱性的物质,F为Al2O3.
解答:解:I为红褐色沉淀,为Fe(OH)3,由转化关系可知,H为Fe(OH)2,G为FeCl2,B为Fe;
金属A能与盐酸、氢氧化钠溶液反应,A为金属Al,
E为白色沉淀,为Al(OH)3,
由转化关系可知,D为AlCl3,X为碱或水解为碱性的物质,F为Al2O3,
(1)由上述分析可知,F为Al2O3,G为FeCl2;
故答案为:Al2O3,FeCl2;
(2)混合物为铁与铝,铁具有磁性,可以利用磁铁吸出铁进行分离;
故答案为:利用磁铁吸出铁;
(3)D→E的转化为AlCl3→Al(OH)3,X为碱或水解为碱性的物质,加入过量的X,X不能是强碱,故X可能是氨水、碳酸钠、碳酸氢钠、偏铝酸钠等,
故选:BC;
(4)A→C为铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,2Al+2NaOH+2H2O═2NaAlO2+3H2↑
铝和氧化铁发生铝热反应生成铁和氧化铝,反应方程式为Fe2O3+2Al
2Fe+Al2O3,
高温下,铁和水蒸气反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)
4H2+Fe3O4,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;Fe2O3+2Al
2Fe+Al2O3;3Fe+4H2O(g)
4H2+Fe3O4.
金属A能与盐酸、氢氧化钠溶液反应,A为金属Al,
E为白色沉淀,为Al(OH)3,
由转化关系可知,D为AlCl3,X为碱或水解为碱性的物质,F为Al2O3,
(1)由上述分析可知,F为Al2O3,G为FeCl2;
故答案为:Al2O3,FeCl2;
(2)混合物为铁与铝,铁具有磁性,可以利用磁铁吸出铁进行分离;
故答案为:利用磁铁吸出铁;
(3)D→E的转化为AlCl3→Al(OH)3,X为碱或水解为碱性的物质,加入过量的X,X不能是强碱,故X可能是氨水、碳酸钠、碳酸氢钠、偏铝酸钠等,
故选:BC;
(4)A→C为铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,2Al+2NaOH+2H2O═2NaAlO2+3H2↑
铝和氧化铁发生铝热反应生成铁和氧化铝,反应方程式为Fe2O3+2Al
| ||
高温下,铁和水蒸气反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)
| ||
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;Fe2O3+2Al
| ||
| ||
点评:“无机框图题”的形式考查元素单质及其化合物的性质,涉及常用化学用语等,难度中等,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力,I的颜色及金属A能与盐酸、氢氧化钠溶液反应是推断突破口.

练习册系列答案
相关题目