题目内容
下列反应的离子方程式正确的是
A.氢氧化铜和盐酸反应:OH-+H+=H2O
B.钠和水反应:Na+2H2O=Na++2OH-+H2↑
C.铁和稀硝酸反应:Fe+2H+=Fe2++H2↑
D.常温下,NaOH溶液和Cl2反应:2OH-+Cl2=Cl-+ClO-+H2O
D
【解析】
试题解析:氢氧化铜是不溶物,应保留化学式,故A错误;电荷不守恒,故B错误;稀硝酸有强氧化性,与活泼金属反应不能产生氢气,故C错误;氯气在氢氧化钠溶液中发生自身氧化还原反应,故D正确。
考点:离子方程式正误判断

(10分)进入2013年以来,我国中东部地区多次遭遇大范围、长时间的雾霾天气。车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。
(1)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
T/℃ n/mol
| 活性炭 | NO | E | F |
初始 | 2.030 | 0.10 | 0 | 0 |
T1 | 2.000 | 0.040 | 0.030 | 0.030 |
T2 | 2.005 | 0.050 | 0.025 | 0.025 |
①结合上表数据,写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数K1= 。
③根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2 b.T1<T2 c.无法比较
(2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:2CO+2NO N2+2CO2 在一体积为1L的密闭容积中,加入0.40mol的CO和0.40mol的NO ,反应中N2的物质的量浓度的变化情况如图所示,回答下列问题。
N2+2CO2 在一体积为1L的密闭容积中,加入0.40mol的CO和0.40mol的NO ,反应中N2的物质的量浓度的变化情况如图所示,回答下列问题。

①计算从反应开始到平衡时,平均反应速率v(N2)= 。
②在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时N2的浓度约为0.25 mol·L-1)。请在上图中画出第5分钟末到此平衡时N2浓度的变化曲线。


 )随温度的变化如下图所示(样品在300℃前失去结晶水,图中A、B、C、D各处固体均为纯净物,其中C、D为氧化物)。
)随温度的变化如下图所示(样品在300℃前失去结晶水,图中A、B、C、D各处固体均为纯净物,其中C、D为氧化物)。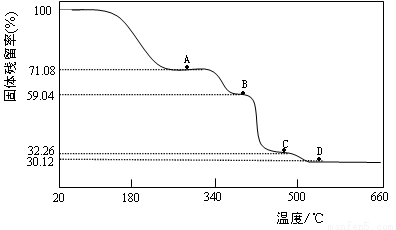
 物质
物质