题目内容
(12分)Co2(OH)2CO3和Co(CH3COO)2·nH2O均是生产高比能锂电池正极材料的前驱体。
(1)这两种钴的化合物中钴的化合价为 。
(2)Co2(OH)2CO3在空气中充分加热生成四氧化三钴,该反应的化学方程式为 。
(3)为确定Co(CH3COO)2·nH2O中的n值及其热分解过程,取一定量的样品在氮气氛围中加热,样品的固体残留率( )随温度的变化如下图所示(样品在300℃前失去结晶水,图中A、B、C、D各处固体均为纯净物,其中C、D为氧化物)。
)随温度的变化如下图所示(样品在300℃前失去结晶水,图中A、B、C、D各处固体均为纯净物,其中C、D为氧化物)。

①Co(CH3COO)2·nH2O晶体中n= (填自然数)。
②A→B点反应释放的气体为纯净物(由两种元素组成),该气体的结构简式为 。
③B→C点反应释放CO、CO2两种气体,n(CO)∶n(CO2)= 。
④D点残留固体的化学式为 。(列出上述计算过程)
(1)+2 (2分);(2)3Co2(OH)2CO3 + O2  2Co3O4 +3CO2 +3H2O (2分)
2Co3O4 +3CO2 +3H2O (2分)
(3)①4 ② CH3CH3 ③2∶1 ④CoO(共8分,每空2分)
【解析】
试题分析:(1)根据化合物中正负化合价的代数和是0 的原则可知:在这两种钴的化合物中钴的化合价为+2价;(2)Co2(OH)2CO3在空气中充分加热生成四氧化三钴,根据电子守恒及元素的原子守恒可得该反应的化学方程式为3Co2(OH)2CO3 + O2 2Co3O4+3CO2 +3H2O;(3)在晶体中Co(CH3COO)2·nH2O结晶水与固体残留物的质量成正比,18n:(177+18n)=(100-71.08):100,解得n=4;故原化合物为Co(CH3COO)2·4H2O,其相对分子质量为249; ②
2Co3O4+3CO2 +3H2O;(3)在晶体中Co(CH3COO)2·nH2O结晶水与固体残留物的质量成正比,18n:(177+18n)=(100-71.08):100,解得n=4;故原化合物为Co(CH3COO)2·4H2O,其相对分子质量为249; ② 
 MrB = 147,减少的物质相对分子质量为177-147=30,因是纯净物该气体只能为乙烷,结构简式是CH3CH3;B处的剩余固体为CoC2O4;③
MrB = 147,减少的物质相对分子质量为177-147=30,因是纯净物该气体只能为乙烷,结构简式是CH3CH3;B处的剩余固体为CoC2O4;③  Mrc= 80.33,故为Co3O4,3CoC2O4
Mrc= 80.33,故为Co3O4,3CoC2O4  Co3O4+4CO↑+ 2CO2↑,故n(CO)∶n(CO2)=2∶1; ④
Co3O4+4CO↑+ 2CO2↑,故n(CO)∶n(CO2)=2∶1; ④ 
 MrD=75 ,故为氧化钴,化学式是CoO。
MrD=75 ,故为氧化钴,化学式是CoO。
考点:考查物质的分解产物、得到的固体化学式的确定的知识。

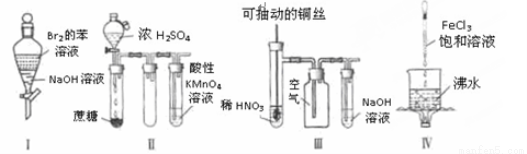



 物质成分的实验中,下列根据实验现象得出的结论正
物质成分的实验中,下列根据实验现象得出的结论正 确的是
确的是
