题目内容
20.已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+,则下列说法不正确的是( )| A. | 反应过程中可以看到白色沉淀先转化为灰绿色后转化为红褐色 | |
| B. | 若Fe2+失去4mol电子,生成氧气的体积在标准状况下约为22.4L | |
| C. | 4 mol Na2O2在反应中共得到6NA个电子 | |
| D. | 该反应中Na2O2既是氧化剂又是还原剂,O2是氧化产物 |
分析 A.Fe2+被Na2O2氧化生成Fe(OH)3;
B.若Fe2+失去4mol电子,则参加反应得到Fe2+为4mol,可知生成的氧气为1mol;
C.过氧化钠中氧元素化合价从-1价升高到0价,降低到-2价,4mol过氧化钠有1mol做还原剂,3mol做氧化剂;
D.Fe元素的化合价由+2价升高为+3价,过氧化钠中O元素的化合价由-1价升高为0,由-1价降低为-2价.
解答 解:A.Fe2+氧化生成Fe(OH)3,反应直接生成红褐色沉淀,所以反应过程中看不到白色沉淀转化为灰绿色再转化为红褐色沉淀的现象,故A错误;
B.若Fe2+失去4mol电子,则参加反应得到Fe2+为4mol,可知生成的氧气为1mol,则生成氧气的体积在标准状况下约为22.4L,故B正确误;
C.过氧化钠中氧元素化合价从-1价升高到0价,降低到-2价,4mol过氧化钠有1mol做还原剂,3mol做氧化剂,Na2O2在反应中得到电子6mol电子,即得到6NA个电子,故C正确;
D.Fe元素的化合价由+2价升高为+3价,过氧化钠中O元素的化合价由-1价升高为0,由-1价降低为-2价,反应中Na2O2既是氧化剂又是还原剂,O2是氧化产物,故D正确,
故选:A.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念和转移电子数的考查,题目难度中等.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
11.某烃0.5mol最多能和1mol HCl加成,生成氯代烃,此氯代烃l mol能和4mol Cl2发生取代反应,生成物中只有碳氯两种元素,此烃为( )
| A. | C2H2 | B. | C2H4 | C. | C3H4 | D. | C6H6 |
15.工业上用某矿渣(主要成分是Cu2O,少量杂质是Al2O3、Fe2O3和SiO2)提取铜的操作流程如下:
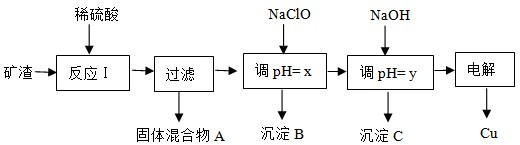
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)固体混合物A中的成分是SiO2、Cu(填化学式).
(2)反应I完成后,铁元素的存在形式为Fe2+(填离子符号).
(3)y的数值范围是5.2≤pH<5.4.
(4)若电解法获得Cu 64.0g,则原矿渣中Cu2O的质量是c.
a、144.0gb、大于144.0g c、小于144.0g
(5)下列关于用NaClO调节溶液pH的说法正确的是b.
a、加入NaClO可使溶液的pH降低
b、NaClO能调节pH的主要原因是由于发生反应:ClO-+H+=HClO,ClO-消耗H+,从而达到调节pH的目的
c、NaClO能调节pH的主要原因是由于NaClO水解:ClO-+H2O?HClO+OH-消耗H+,从而达到调节pH的目的.
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO.

已知:Cu2O+2H+=Cu+Cu2++H2O
| 沉淀 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 2.2 | 5.8 |
| 沉淀完成pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)反应I完成后,铁元素的存在形式为Fe2+(填离子符号).
(3)y的数值范围是5.2≤pH<5.4.
(4)若电解法获得Cu 64.0g,则原矿渣中Cu2O的质量是c.
a、144.0gb、大于144.0g c、小于144.0g
(5)下列关于用NaClO调节溶液pH的说法正确的是b.
a、加入NaClO可使溶液的pH降低
b、NaClO能调节pH的主要原因是由于发生反应:ClO-+H+=HClO,ClO-消耗H+,从而达到调节pH的目的
c、NaClO能调节pH的主要原因是由于NaClO水解:ClO-+H2O?HClO+OH-消耗H+,从而达到调节pH的目的.
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO.
9.下列实验事实不能用平衡移动原理解释的是( )
| A. |  将NO2球浸泡在冷水和热水中 | |||||||||
| B. |
| |||||||||
| C. |
| |||||||||
| D. | 向SO2水溶液中滴加氯水后,溶液的pH值减小 |
 ;
;

 .
. .
. .
. .
.