题目内容
0.25molR单质与盐酸反应,在标准状况下产生5.6L氢气和0.25mol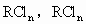 可被氧化成
可被氧化成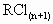 .现已知
.现已知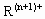 离子的M电子层有13个电子,试回答:
离子的M电子层有13个电子,试回答:
(1)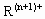 离子的化合价是________,R原子的结构简图为________;R元素位于元素周期表的第________周期________族.
离子的化合价是________,R原子的结构简图为________;R元素位于元素周期表的第________周期________族.
(2)取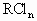 溶液,通入
溶液,通入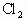 ,现象________,离子方程式为________.
,现象________,离子方程式为________.
(3)取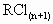 溶液,加入少量金属钠,可观察到的现象是________,离子方程式为________.
溶液,加入少量金属钠,可观察到的现象是________,离子方程式为________.
答案:
解析:
解析:
|
(1)+3, (2)溶液由浅绿变为棕黄色, (3)有气体产生,同时有红褐色沉淀产生,2Na+ |

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
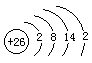 ,4,Ⅷ
,4,Ⅷ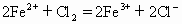
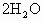 =
=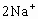 +
+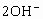 +
+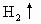 ,
,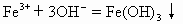
 有A、B、C、D、E五种短周期元素,它们的原子序数由A到E依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物.D为原子核内有12个中子的二价金属,当2.4克D与盐酸反应时,在标准状况下放出气体2.24L.
有A、B、C、D、E五种短周期元素,它们的原子序数由A到E依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物.D为原子核内有12个中子的二价金属,当2.4克D与盐酸反应时,在标准状况下放出气体2.24L.