题目内容
在标准状况下,将224L HCl气体溶于635mL(ρ=1.00g?cm-3)的水中,所得盐酸的密度为1.20g?cm-3.试求:
(1)该盐酸的物质的量浓度 .
(2)标准状况下,取这种盐酸100mL,与足量的NaHCO3溶液反应后,放出 升气体;气体干燥后,通过盛有足量Na2O2固体的容器,充分反应后,容器内固体增重 克.
(1)该盐酸的物质的量浓度
(2)标准状况下,取这种盐酸100mL,与足量的NaHCO3溶液反应后,放出
考点:物质的量浓度的相关计算,化学方程式的有关计算
专题:计算题
分析:(1)根据n=
计算HCl的物质的量,根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液的体积,结合V=
计算溶液的体积,再根据c=
计算盐酸物质的量浓度;
(2)根据n=cV计算n(HCl),再根据NaHCO3+HCl=NaCl+CO2↑+H2O计算生成二氧化碳的体积;根据2Na2O2+2CO2=2Na2CO3+O2,利用差量法计算固体增重.
| V |
| Vm |
| m |
| ρ |
| n |
| V |
(2)根据n=cV计算n(HCl),再根据NaHCO3+HCl=NaCl+CO2↑+H2O计算生成二氧化碳的体积;根据2Na2O2+2CO2=2Na2CO3+O2,利用差量法计算固体增重.
解答:
解:(1)n(HCl)=
=10mol,m(HCl)=10mol×36.5g/mol=365g,
溶液质量为365g+635mL×1g/mL=1000g,
则溶液的体积为
=
L,
则c(HCl)=
=12mol/L,
故答案为:12mol/L;
(2)上述盐酸100mL,则n(HCl)=0.1L×12mol/L=1.2mol,则:
NaHCO3+HCl=NaCl+CO2↑+H2O
1mol 1mol
1.2mol 1.2mol
故可以得到二氧化碳的体积=1.2mol×22.4L/mol=26.88L,
二氧化碳的质量=1.2mol×44g/mol=52.8g
2Na2O2+2CO2=2Na2CO3+O2,固体增重
88 56
52.8g△m
故固体增重△m=
=33.6g
故答案为:26.88;33.6.
| 224L |
| 22.4L/mol |
溶液质量为365g+635mL×1g/mL=1000g,
则溶液的体积为
| 1000g |
| 1200g/L |
| 5 |
| 6 |
则c(HCl)=
| 10mol | ||
|
故答案为:12mol/L;
(2)上述盐酸100mL,则n(HCl)=0.1L×12mol/L=1.2mol,则:
NaHCO3+HCl=NaCl+CO2↑+H2O
1mol 1mol
1.2mol 1.2mol
故可以得到二氧化碳的体积=1.2mol×22.4L/mol=26.88L,
二氧化碳的质量=1.2mol×44g/mol=52.8g
2Na2O2+2CO2=2Na2CO3+O2,固体增重
88 56
52.8g△m
故固体增重△m=
| 52.8g×56 |
| 88 |
故答案为:26.88;33.6.
点评:本题考查物质的量浓度、根据化学方程式的计算等,侧重于学生的分析能力和计算能力的考查,难度中等,注意对概念的理解与公式的灵活运用,(2)中注意差量法的应用.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
下列说法不正确的是( )
| A、漂白粉长时间露置空气中会变质失效 |
| B、澄清石灰水可用来鉴别Na2CO3和NaHCO3溶液 |
| C、高温下SiO2能与Na2CO3反应放出CO2,但不能说明H2SiO3的酸性强于H2CO3 |
| D、金属的化学腐蚀和电化学腐蚀的本质相同,但电化学腐蚀伴有电流产生 |
下列符号中“2”的含义依次正确的一组是( )
H 2He 2Cl Ca2+.
2 1 |
| A、质量数 中子数 质子数 电荷数 |
| B、质子数 中子数 原子个数 电荷数 |
| C、质量数 质子数 原子个数 电荷数 |
| D、质量数 质子数 中子数 电荷数 |
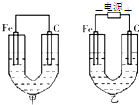 如图所示,甲、乙两池的电极材料都是铁棒与碳棒,请回答:
如图所示,甲、乙两池的电极材料都是铁棒与碳棒,请回答:
