题目内容
13. 如图所示的过程是目前直接利用太阳能的研究热点.人们把通过人工光化学手段合成燃料的过程叫做人工光合作用.
如图所示的过程是目前直接利用太阳能的研究热点.人们把通过人工光化学手段合成燃料的过程叫做人工光合作用.(1)在上图构想的物质和能量循环中太阳能最终转化为热能.
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH,该反应的化学方程式为:2CO2(g)+4H2O(g)$?_{光照}^{催化剂}$2CH3OH(g)+3O2(g).
一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
②能说明该反应已达到平衡状态的是ad.
a.v正(H2O)=2v逆(CO2)
b.n(CH3OH):n(O2)=2:3
c.容器内密度保持不变
d.容器内压强保持不变
(3)用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的负极(填“正”或“负”),通入氧气的一极的电极反应式为O2+4H++4e-=2H2O.
分析 (1)光合作用下生成燃料,燃料燃烧释放出能量;
(2)①根据v=$\frac{△c}{△t}$计算;
②达到平衡时正逆反应速率相等,各物质的浓度、含量不变;
(3)该原电池中,通入甲醇的电极是负极、通入氧气的电极是正极.
解答 解:(1)由据图可知,太阳能首先转化为化学能,其次化学能转化为热能,故答案为:热;
(2)①0~3min内甲醇的物质的量变化0.090mol,则v=$\frac{\frac{0.09mol}{2L}}{3min}$=0.015mol•L-1•min-1,
故答案为:0.015mol•L-1•min-1;
②a.v正(H2O)=2v逆(CO2),可说明正逆反应速率相等,达到平衡状态,故a正确;
b.无论是否达到平衡状态,生成物的物质的量之比都等于化学计量数之比,即n(CH3OH):n(O2)=2:3,故b错误;
c.因气体的体积以及质量不变,则容器内密度保持不变,不能用于判断是否达到平衡状态,故c错误;
d.反应前后气体的体积不等,容器内压强保持不变,可说明达到平衡状态,故d正确.
故答案为:ad;
(3)反应中甲醇被氧化,应为电池的负极,正极发生还原反应,氧气被还原生成水,电极方程式为O2+4H++4e-=2H2O,
故答案为:负;O2+4H++4e-=2H2O.
点评 本题考查化学反应与能量变化、化学平衡的相关计算以及原电池知识,为高频考点,侧重于学生的分析能力的考查,题目有利于培养学生良好的科学素养,提高学习的积极性,注意相关基础知识的积累.

练习册系列答案
相关题目
3.具有下列原子序数的各组元素,能组成化学式AB2型化合物,并且该化合物在固态时为原子晶体的是( )
| A. | 6和8 | B. | 20和17 | C. | 14和8 | D. | 6和16 |
4.下列关于化学反应速率的说法正确的是( )
| A. | 1L0.1 mol•L-1盐酸和1L mol•L-1硫酸分别与1 L2 mol•L-1NaOH溶液反应速率相同 | |
| B. | 化学反应速率为0.8 mol•L-1•s-1,其含义是时间为1s时,某物质的浓度是0.8mol•L-1 | |
| C. | 0.1 mol•L-1硝酸与相同形状和大小的大理石反应的速率相同 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象就越明显 |
1.某化学反应的反应物浓度在20s内由3.0mol/L变为1.0mol/L,则以该反应物浓度的变化表示20s内的平均反应速率为( )
| A. | 0.05 mol/(L•s) | B. | 0.10 mol/(L•s) | C. | 0.15 mol/(L•s) | D. | 2.0 mol/(L•s) |
8.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO 等.
现以硫酸渣制备铁红(Fe2O3),过程如下:

(1)酸溶过程中Fe2O3与稀硫酸反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O.
(2)还原过程中加入FeS2是将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.检验Fe3+被完全还原的实验操作和现象是:取少量试液于试管中,滴入几滴KSCN溶液,若不显红色,则说明Fe3+已被完全还原.
(3)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是3.2~3.8(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
(5)滤液B可以回收的物质有Al2(SO4)3、MgSO4、Na2SO4.
现以硫酸渣制备铁红(Fe2O3),过程如下:

(1)酸溶过程中Fe2O3与稀硫酸反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O.
(2)还原过程中加入FeS2是将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.检验Fe3+被完全还原的实验操作和现象是:取少量试液于试管中,滴入几滴KSCN溶液,若不显红色,则说明Fe3+已被完全还原.
(3)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是3.2~3.8(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
18.下列理论解释和结论都正确的是( )
| 选项 | 理论解释 | 结论 |
| A | H-N的键能大于H-P | 沸点:NH3>PH3 |
| B | 离子半径:Mg2+<Ba2+ | 热分解温度:碳酸镁髙于碳酸钡 |
| C | 离子半径:Na+<Cs+ | 配位数(C.N.):NaCl<CsCl |
| D | 晶格能:FeS2>ZnS | 岩浆中的硫化物矿物析出顺序ZnS先于FeS2 |
| A. | A | B. | B | C. | C | D. | D |
7. 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.
(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)═BaS(s)+4CO(g)△H=+571.2kJ•mol-1
BaS(s)═Ba(s)+S(s)△H=+460kJ•mol-1
已知:O2(g)+2C(s)═2CO(g)△H=-221kJ•mol-1,
请写出O2(g)氧化Ba(s)和S(s)生成1molBaSO4(s)的热化学方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=-1473.2kJ/mol.
(2)二氧化硫在一定条件下还可以发生如下反应:SO2 (g)+NO2(g)?SO3(g)+NO (g)△H=-42kJ•mol-1.在1L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如表:
①实验甲中,若2min 时测得放出的热量是4.2kJ,则0→2min时间内,用SO2(g)表示的平均反应速率υ(SO2)=0.05mol/(L•min)
②实验丙中,达到平衡时,NO2的转化率为40%;a=0.12
③由表中数据可推知,T1<T2(填“>”“<”或“=”),判断的理由是T1时,该反应的平衡常数K1=2.6,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2 .
(3)甲烷在熔融固体氧化物中形成的燃料电池,其工作原理如图所示.
a是电池的正极(填“正”或“负”),b极的电极反应式为CH4+4O2--8e-=CO2+2H2O.
 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)═BaS(s)+4CO(g)△H=+571.2kJ•mol-1
BaS(s)═Ba(s)+S(s)△H=+460kJ•mol-1
已知:O2(g)+2C(s)═2CO(g)△H=-221kJ•mol-1,
请写出O2(g)氧化Ba(s)和S(s)生成1molBaSO4(s)的热化学方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=-1473.2kJ/mol.
(2)二氧化硫在一定条件下还可以发生如下反应:SO2 (g)+NO2(g)?SO3(g)+NO (g)△H=-42kJ•mol-1.在1L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如表:
| 实验 编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(SO2) | n(NO2) | n(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T2 | 0.20 | 0.30 | a |
②实验丙中,达到平衡时,NO2的转化率为40%;a=0.12
③由表中数据可推知,T1<T2(填“>”“<”或“=”),判断的理由是T1时,该反应的平衡常数K1=2.6,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2 .
(3)甲烷在熔融固体氧化物中形成的燃料电池,其工作原理如图所示.
a是电池的正极(填“正”或“负”),b极的电极反应式为CH4+4O2--8e-=CO2+2H2O.
4.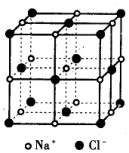 已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )
 已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )| A. | 117α3ρ | B. | $\frac{M}{N{α}^{3}}$ | C. | $\frac{234}{{α}^{3}ρ}$ | D. | $\frac{58.5}{2{α}^{3}ρ}$ |
5.全钒电池以惰性材料作电极,在电解质溶液中发生的电池总反应为:VO2+(蓝色)+H2O+V3+(紫色)$?_{放电}^{充电}$VO2+(黄色)+V2+(绿色)+2H+下列说法错误的( )
| A. | 充电时,反应每生成1mol H+时电子转移的物质的量为1mol | |
| B. | 放电过程中,正极附近溶液的酸性减弱 | |
| C. | 放电时,正极反应为VO2++2H++e-═VO2++H2O | |
| D. | 充电时,阴极附近溶液由紫色逐渐变为绿色 |