题目内容
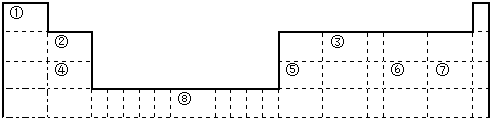
下列关于N2(g)+3H2(g)?2NH3(g)△H<0反应的图象中,错误的是( )
A、 |
B、 |
C、 |
D、 |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:图示题
分析:A、根据反应方程式的反应物和生成物的化学计量数关系可知,增大压强平衡向正方向移动来判断;
B、从温度升高平衡移动的方向来分析,温度升高,平衡逆向移动,氨气的百分含量降低;
C、工业合成氨的正反应是放热反应,温度升高平衡向逆反应方向移动;
D、温度升高反应速率加快,根据平衡移动的方向判断.
B、从温度升高平衡移动的方向来分析,温度升高,平衡逆向移动,氨气的百分含量降低;
C、工业合成氨的正反应是放热反应,温度升高平衡向逆反应方向移动;
D、温度升高反应速率加快,根据平衡移动的方向判断.
解答:
解:A、反应物的化学计量数之和大于生成物的计量数之和,增大压强平衡向正方向移动,氨气的百分含量增大,故A正确;
B、温度升高,平衡逆向移动,氨气的百分含量降低,故B正确;
C、工业合成氨的正反应是放热反应,温度升高平衡向逆反应方向移动,逆反应速率大于正反应速率,故C正确;
D、温度升高反应速率加快,先达到平衡状态,温度升高平衡向逆反应方向移动,氨气的百分含量降低,故D错误;
故选D.
B、温度升高,平衡逆向移动,氨气的百分含量降低,故B正确;
C、工业合成氨的正反应是放热反应,温度升高平衡向逆反应方向移动,逆反应速率大于正反应速率,故C正确;
D、温度升高反应速率加快,先达到平衡状态,温度升高平衡向逆反应方向移动,氨气的百分含量降低,故D错误;
故选D.
点评:本题考查化学平衡移动的图象题,题目难度不大,做题时注意分析图象曲线特点,从影响平衡移动的因素来分析.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
下列离子方程式的书写正确的是( )
| A、Cu与AgNO3溶液反应:Cu+Ag+═Cu2++Ag |
| B、Fe与盐酸的反应放出H2:Fe+2H+═Fe2++H2↑ |
| C、大理石与盐酸反应放出CO2气体:CO32-+2H+═CO2↑+H2O |
| D、氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ |
瓦斯中甲烷与氧气的体积比为1:2时极易爆炸,则此时甲烷与氧气的质量比为( )
| A、1:1 | B、2:1 |
| C、1:4 | D、4:1 |
下列说法正确的是( )
| A、中和热一定是强酸跟强碱反应放出的热量 |
| B、1 mol酸与1 mol碱完全反应放出的热量是中和热 |
| C、在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热 |
| D、测定中和热时可用稀硫酸和稀Ba(OH)2溶液 |
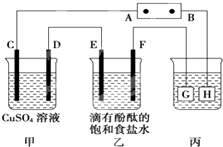 如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.