题目内容
19.写出下列反应的化学反应方程式:(1)实验室制取乙烯CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O
(2)苯与液溴反应
 .
.
分析 (1)乙醇与浓硫酸混合加热到170℃发生消去反应生成乙烯;
(2)苯与液溴发生取代反应生成溴苯和HBr.
解答 解:(1)乙醇与浓硫酸混合加热到170℃发生消去反应去掉羟基和邻为碳原子上的氢原子,生成乙烯,反应的化学方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)苯与液溴发生取代反应,生成溴苯和HBr,故化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的官能团与性质为解答的关键,侧重分析与应用能力的考查,注意有机反应的判断,题目难度不大.

练习册系列答案
相关题目
9.能正确表示下列反应的离子方程式为( )
| A. | 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O | |
| B. | 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ | |
| C. | 磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O | |
| D. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
7.某实验小组只领取了下列仪器和用品:铁架台、铁夹、铁圈、三脚架、石棉网、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、滤纸、火柴.不能进行的实验操作是( )
| A. | 蒸发 | B. | 蒸馏 | C. | 过滤 | D. | 萃取 |
14.当光束通过下列分散系时,可能产生丁达尔效应的是( )
| A. | 牛奶 | B. | 鸡蛋清 | C. | 食盐水 | D. | 盐酸 |
4.已知向某溶液中逐滴加入NaOH溶液时,测得生成沉淀的质量随所加入NaOH的体积变化如图所示,则该溶液中大量含有的离子可能是( )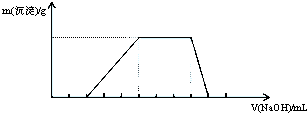

| A. | H+、Al3+、AlO2-、SO42- | B. | H+、NH4+、Al3+、NO3- | ||
| C. | H+、NH4+、Mg2+、Cl- | D. | NH4+、Al3+、Cl-、SO42- |
11.用CH4催化还原NOx,可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
下列说法正确的是( )
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
下列说法正确的是( )
| A. | 当反应相同体积的CH4时反应①②转移的电子数相同 | |
| B. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1 | |
| C. | 反应②中当生成4.48 L CO2时转移的电子总数为1.60 mol | |
| D. | 若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ |
8.下列有关元素的性质及其递变规律正确的是( )
| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 同主族元素的简单阴离子还原性越强,对应单质的氧化性越强 | |
| D. | ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |