题目内容
下列有关元素周期表叙述不正确的是( )
| A、元素周期表有7个横行也称7个周期,有18个纵行16个族组成 |
| B、在周期表中,第三、四、五、六周期元素的数目分别是8,18,18,32 |
| C、如果把元素周期表从左至右18个纵行称为18列,则第VA族在第15列 |
| D、稀有气体又称0族元素,因为它们最外层均为8电子稳定结构性质不活泼 |
考点:元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:A、元素周期表有7个横行三个短、三长、一不全,也称7个周期,有18个纵行七主、七副、零与ⅥⅡ,共16个族组成;
B、每周期元素种类数目分别为2、8、8、18、18、32、32种;
C、如果把元素周期表从左至右18个纵行称为18列,第15列则为第VA族;
D、氦也是稀有气体,但最外层只有2个电子.
B、每周期元素种类数目分别为2、8、8、18、18、32、32种;
C、如果把元素周期表从左至右18个纵行称为18列,第15列则为第VA族;
D、氦也是稀有气体,但最外层只有2个电子.
解答:
解:A、元素周期表有7个横行三个短、三长、一不全,也称7个周期,有18个纵行七主、七副、零与ⅥⅡ,共16个族组成,故A正确;
B、每周期元素种类数目分别为2、8、8、18、18、32、32种,所以在周期表中,第三、四、五、六周期元素的数目分别是8,18,18,32,故B正确;
C、如果把元素周期表从左至右18个纵行称为18列,第15列则为第VA族,氮族元素,故C正确;
D、氦也是稀有气体,但最外层只有2个电子,故D错误;
故选D.
B、每周期元素种类数目分别为2、8、8、18、18、32、32种,所以在周期表中,第三、四、五、六周期元素的数目分别是8,18,18,32,故B正确;
C、如果把元素周期表从左至右18个纵行称为18列,第15列则为第VA族,氮族元素,故C正确;
D、氦也是稀有气体,但最外层只有2个电子,故D错误;
故选D.
点评:本题考查结构性质位置关系,比较基础,注意元素周期律的理解掌握,注意识记周期表中一些特殊性.

练习册系列答案
相关题目
1mol乙烯与氯气完全加成后再与氯气取代,整个过程最多需氯气( )
| A、1mol | B、4mol |
| C、5mol | D、6mol |
如下四套装置,下列有关的说法不正确的是( )

| A、甲装置:石墨电极上产生的气体是H2 |
| B、乙装置:铁电极被消耗,发生氧化反应 |
| C、丙装置:能够验证铁发生析氢腐蚀 |
| D、丁装置:当X极的电极材料是锌时,保护铁 |
据美国《科学》杂志报道,外太空的某个星球的大气层中含有大量的CH2=CHOH,此物质常温下为液体,不稳定,易转化为CH3CHO,化学方程式为:CH2=CHOH═CH3CHO+Q (Q>0).据此,以下叙述中不正确的是( )
| A、该星球表面温度很低 |
| B、低温下稳定性:CH2=CHOH<CH3CHO |
| C、常温下CH2=CHOH具有的能量比CH3CHO高 |
| D、高温下稳定性:CH2=CHOH>CH3CHO |
图是某学校实验室从化学试剂商店买回来的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A、该硫酸的物质的量浓度为9.2 mol?L-1 |
| B、该硫酸50 mL与足量的铜反应可得到标准状况下SO2 0.46 mol |
| C、要配制250 mL 4.6 mol?L-1的稀硫酸需取该硫酸62.5 mL |
| D、等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2 mol?L-1 |
下列说法正确的是( )
| A、当分子间距离增大时,分子间的引力增大、斥力减小 |
| B、温度是系统中分子总动能大小的标志 |
| C、布朗运动指的是悬浮小颗粒的无规则运动 |
| D、当系统与外界没有热交换时,温度一定保持不变 |
下列物质所对应的化学式不正确的是( )
| A、干冰--CO2 |
| B、硫化亚铁--FeS2 |
| C、苏打--Na2CO3 |
| D、重晶石--BaSO4 |
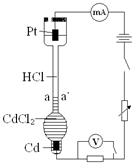 设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu).恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa′处形成清晰的界面.通电后,可观察到清晰界面缓缓向上移动.下列说法正确的是( )
设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu).恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa′处形成清晰的界面.通电后,可观察到清晰界面缓缓向上移动.下列说法正确的是( )| A、通电时,H+、Cd2+向Cd电极迁移,Cl-向Pt电极迁移 | ||||
| B、一定时间内,如果通过HCl溶液某一界面的总电量为1.0 C,测得H+所迁移的电量为0.82 C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍 | ||||
| C、如果电源正负极反接,则下端产生大量Cl2,使界面不再清晰,实验失败 | ||||
D、装置中总反应的化学方程式为:2HCl
|