题目内容
 已知金晶体是面心立方晶格(如图所示).金的原子半径为A pm,金的密度表达式为
已知金晶体是面心立方晶格(如图所示).金的原子半径为A pm,金的密度表达式为考点:晶胞的计算
专题:化学键与晶体结构
分析:根据晶胞类型计算出晶胞所含原子数,根据公式ρ=
计算得到.
| m |
| V |
解答:
解:晶胞中金原子位于顶点和面心,数目为8×
+6×
=4,该晶胞体积为A3×10-30 cm3,该晶胞的质量为
,则该晶胞的密度为
=
g?cm-3,
故答案为:
.
| 1 |
| 8 |
| 1 |
| 2 |
| 4M |
| NA |
| 4M |
| NA×A3×10-30 |
| 4M×1030 |
| NA×A3 |
故答案为:
| 4M×1030 |
| NA×A3 |
点评:本题考查晶胞密度计算,难度不大,必须明确晶胞中所含微粒数目,不然容易出现错误.

练习册系列答案
相关题目
常温下,下列离子或分子在指定溶液中能大量共存的一组是( )
| A、FeCl3饱和溶液:K+、I-、Cl-、H+ |
| B、使紫色石蕊试液变蓝色的溶液:Na+、NO3-、Br-、NH3?H2O |
| C、pH=1的溶液:Cr2O72-、K+、NO3-、C2H5OH |
| D、能溶解Al2O3的溶液:Na+、Mg2+、HCO3-、Cl- |
25℃时,a mol?L-1 HCl溶液与b mol?L-1一元碱BOH等体积混合后,pH为7,则下列关系可能正确的是( )
| A、a>b |
| B、a<b |
| C、c(Cl-)>c(B+) |
| D、c(Cl-)<c(B+) |
一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙、丙、丁四个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热量(Q),及平衡时的转化率(X)如下表所示:
下列叙述正确的是( )
| 容器 | 起始时各物质的量(mol) | 到达平衡时放出 的热量(QkJ) |
平衡时SO2转化率(X) | |||
| SO2 | O2 | SO3 | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 0 | Q2=39.4 | X2 |
| 丙 | 1 | 0.5 | 0 | 1 | Q3 | X3 |
| 丁 | 1.8 | 0.9 | 0.2 | 0 | Q4 | X4 |
| A、Q1=78.8 |
| B、Q1=Q4>Q2=Q3 |
| C、X1>X3=40% |
| D、X1=X4>X2=X3 |
下列关于范德华力的叙述中,正确的是( )
| A、范德华力的实质也是一种电性作用,所以范德华力是一种特殊化学键 |
| B、任何分子间在任意情况下都会产生范德华力 |
| C、范德华力与化学键的区别是作用力的强弱问题 |
| D、范德华力非常微弱,故破坏范德华力不需要消耗能量 |
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验. )的分子式为
)的分子式为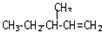 一定条件发生加聚反应时的化学方程式
一定条件发生加聚反应时的化学方程式 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下: