题目内容
14.有关有机化学实验的说法正确的是( )| A. | 实验室制备乙烯时,产生的气体使溴水褪色,能证明有乙烯生成 | |
| B. | 加热NaOH和少量溴乙烷的混合液后滴加硝酸银,可生成浅黄色沉淀 | |
| C. | 制取硝基苯时,试管中先加入浓H2SO4,再逐滴滴入浓HNO3和苯,振荡混合均匀后,保持55℃水浴加热 | |
| D. | 除去溴苯中的溴,可用稀NaOH溶液反复洗涤,并用分液漏斗分液 |
分析 A.浓硫酸具有强氧化性,能够发生副反应生成二氧化硫;
B.氢氧根离子能够与银离子反应,应排除OH-离子的干扰;
C.浓硫酸加入的顺序错误,易发生危险;
D.溴与氢氧化钠溶液反应,溴苯与氢氧化钠溶液不反应.
解答 解:A.由于反应中有副产物二氧化硫生成,二氧化硫能够与溴水反应使溴水褪色,所以必须先将二氧化硫杂质除去再检验乙烯,故A错误;
B.加入硝酸银溶液前应先加入酸中和氢氧化钠,排除OH-离子的干扰,故B错误;
C.应该先加入苯,再加入浓硫酸,滴加顺序颠倒,容易发生危险,故C错误;
D.由于溴苯与氢氧化钠溶液不发生反应,而与溴能够发生反应,反应后混合液分层,所以可用稀NaOH溶液反复洗涤,并用分液漏斗分液,故D正确;
故选D.
点评 本题考查化学实验方案的评价,涉及化学实验基本操作方面的知识,涉及了除杂、加入试剂顺序、气体的检验方法等知识,题目难度中等,试题侧重实验基本操作和实验原理的考查,有利于提高学生的分析能力及化学实验能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.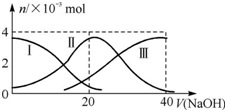 常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )
常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )
 常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )
常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )| A. | 当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| B. | 等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水小 | |
| C. | NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) | |
| D. | 向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减小 |
20.如图所示关于该化合物的下列说法正确的是( )
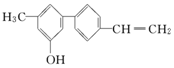

| A. | 完全燃烧时只有二氧化碳和水两种产物 | |
| B. | 由于含有氧元素不是有机物 | |
| C. | 该分子中含有羟基属于醇 | |
| D. | 不能使溴水褪色 |
9.一次性使用的聚苯乙烯材料带来的“白色污染”是一种较为严重的污染现象.最近研制的一种新型材料能代替聚苯乙烯,它是由乳酸聚合而成的,这种材料可以在乳酸菌作用下完全降解生成CO2和H2O.下列关于聚乳酸的说法中,正确的是( )
| A. | 聚乳酸是一种纯净物 | |
| B. | 聚乳酸的聚合方式与聚苯乙烯相似 | |
| C. | 聚乳酸的单体为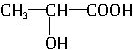 | |
| D. | 聚乳酸的降解过程不需要其他物质参与反应 |
19.下列说法不正确的是( )
| A. | 氧化性(酸性溶液):PbO2>Fe3+>S | |
| B. | 还原性(碱性溶液):Fe(OH)2>KCl>Cl2 | |
| C. | 酸性(水溶液):H2S>H2SO4>H2SeO4>HN3 | |
| D. | 热稳定性:CaCO3>FeCO3>Ag2CO3 |
6.下列有关方程式正确的是( )
| A. | 向硫酸亚铁溶液中加入双氧水的离子方程式:Fe2++2H2O+4H+=Fe3++4H2O | |
| B. | 粗硅制备的化学方程式:C+SiO2$\frac{\underline{\;高温\;}}{\;}$CO2↑+Si | |
| C. | 石墨作电极电解CuSO4溶液的离子方程式:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 铁发生吸氧腐蚀时负极上的电极反应式:Fe-3e-=Fe3+ |
 .
.
 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题: