题目内容
2.已知煤矸石经处理后含SiO2(65%)、Al2O3(25%)、Fe2O3(10%).按以下流程制备Al(OH)3: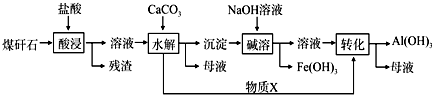
(1)若取该煤矸石1000g按上述流程“酸浸”之后,对所得“溶液”直接加热蒸干再经灼烧,最终所得固体的成分及质量分别是Al2O3250克、Fe2O3100g(不考虑实验过程中的损失).
(2)上述沉淀的主要化学成分是Al(OH)3、Fe(OH)3,物质X是一种常见气体,它的电子式为
 .
.(3)“碱溶”时反应的主要离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(4)“转化”时,若物质X是足量的,则主要反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(5)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4.为了获得更多产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作的实验方案是:加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加CaCO3调节pH到5.4,过滤得到Al(OH)3.
分析 含SiO2(65%)、Al2O3(25%)、Fe2O3(10%)化合物用盐酸酸浸发生的反应为:Al2O3+6H+═2Al3++3H2O;Fe2O3+6H+═2Fe3++3H2O;则过滤的溶液为氯化铁和氯化铝的溶液,加碳酸钙消耗溶液中的氢离子使三价铁离子、三价铝离子都水解生成氢氧化铁、氢氧化铝的沉淀,所以再加入氢氧化钠,只要氢氧化铝溶解反应为:Al(OH)3+OH-═AlO2-+2H2O,所得溶液为偏铝酸钠溶液再通入二氧化碳进一步反应又生成氢氧化铝,据此答题.
解答 解:含SiO2(65%)、Al2O3(25%)、Fe2O3(10%)及少量钙镁的化合物用盐酸酸浸发生的反应为:Al2O3+6H+═2Al3++3H2O;Fe2O3+6H+═2Fe3++3H2O;则过滤的溶液为氯化铁和氯化铝的溶液,加碳酸钙消耗溶液中的氢离子使三价铁离子、三价铝离子都水解生成氢氧化铁、氢氧化铝的沉淀,所以再加入氢氧化钠,只要氢氧化铝溶解反应为:Al(OH)3+OH-═AlO2-+2H2O,所得溶液为偏铝酸钠溶液再通入二氧化碳进一步反应又生成氢氧化铝.
(1)过滤的溶液为氯化铁和氯化铝的溶液,对所得“溶液”直接加热蒸干再经灼烧,最终所得固体的成分Al2O3 a克、Fe2O3b克,则:a=1000g×25%=250g,b=1000g×10%=100g,故答案为:Al2O3 250克、Fe2O3100g;
(2)加碳酸钙消耗溶液中的氢离子使三价铁离子、三价铝离子都水解生成氢氧化铁、氢氧化铝的沉淀,氯化铝和氯化铁水解都生成盐酸,碳酸钙和盐酸反应生成氯化钙和二氧化碳,所以物质X是二氧化碳,它的电子式为 ,故答案为:Al(OH)3、Fe(OH)3,
,故答案为:Al(OH)3、Fe(OH)3, ;
;
(3)加入氢氧化钠,只要氢氧化铝溶解反应为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)物质X(二氧化碳)是足量的,则主要反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(5)Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4,为了获得更多产品Al(OH)3,加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加CaCO3调节pH到5.4,过滤得到Al(OH)3,故答案为:加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加CaCO3调节pH到5.4,过滤得到Al(OH)3.
点评 本题以工艺流程为载体考查了溶解平衡原理、物质间的反应、除杂等知识点,这种题型是高考常考题型,综合性较强,涉及知识面较广,用教材基础知识采用知识迁移的方法分析解答,难度不大.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | 天然的油脂大多数为混甘油酯 | |
| B. | 油脂在碱性条件下水解更彻底,工业应用该反应制肥皂 | |
| C. | 油脂分为液态的油和固体的脂肪 | |
| D. | 油脂没有不饱和双键,所以,油脂不能使高锰酸钾溶液反应 |
①氢气能在氯气中燃烧产生黄色火焰,生成白烟
②铜丝在氯气中燃烧,生成蓝绿色的氯化铜
③液氯就是氯的水溶液,它能使干燥的有色布条褪色
④氯气能与氢氡化钙反应生成漂白粉,漂白粉的成分只有次氯酸钙
⑤自然界中存在大量氯的单质.
| A. | 只有①⑤ | B. | ①②③ | C. | 全部 | D. | ①④⑤ |
| 选项 | 实验目的 | 实验操作 | 实验原理 |
| A | 用普通酒精精制无水酒精 | 加入硫酸铜,蒸馏 | 硫酸铜吸水 |
| B | 除去乙醇中少量乙酸 | 加入钠,分液 | 乙酸与钠反应 |
| C | 分离甲酸丙酯和丙酸甲酯 | 蒸馏 | 它们的沸点不同 |
| D | 除去硝基苯中少量稀酸溶液 | 加入石油醚,萃取 | 石油醚溶解硝基苯 |
| A. | A | B. | B | C. | C | D. | D |
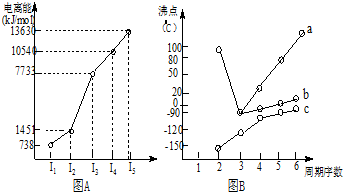
II.图B折线c可以表达出第IVA族元素氢化物的沸点的变化规律;两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线:a和b,你认为正确的是:b(填“a”或“b”).
已知部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 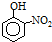 | 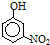 |  |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母).
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(3)金属是钛(Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布方式为3d24s2;
II.钢铁表面镀有下列金属时,当镀层部分被破坏时,铁不易被腐蚀的是b.(填字母)
a.Sn b.Zn c.Cu d.Pb.
| A. | 实验室制备乙烯时,产生的气体使溴水褪色,能证明有乙烯生成 | |
| B. | 加热NaOH和少量溴乙烷的混合液后滴加硝酸银,可生成浅黄色沉淀 | |
| C. | 制取硝基苯时,试管中先加入浓H2SO4,再逐滴滴入浓HNO3和苯,振荡混合均匀后,保持55℃水浴加热 | |
| D. | 除去溴苯中的溴,可用稀NaOH溶液反复洗涤,并用分液漏斗分液 |