题目内容
20.Na2O2、Na2O、NaOH、NaCl可按照某标准划分为同一类物质:①钠盐、②电解质、③钠的化合物、④钠的含氧化合物.上述分类标准正确的是( )| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
分析 如果将Na2O2、Na2O、NaOH、NaCl可按某种标准划为同一类物质,就要分析这些物质的共同点,它们都有两种或两种以上元素组成,属于化合物;都能在水溶液中或熔融状态下导电,为电解质;都是由阳离子和阴离子构成的化合物,为离子化合物.
解答 解:①Na2O2、Na2O都是由钠元素和氧元素组成,Na2O属于氧化物;Na2O2属于过氧化物,NaOH电离出的阴离子全为氢氧根离子,属于碱;NaCl电离出钠离子和氯离子,属于钠盐,故①错误;
②Na2O2、Na2O、NaOH、NaCl在水溶液中或熔融状态下能导电,属于电解质,故②正确;
③Na2O2、Na2O、NaOH、NaCl都是由两种或两种以上元素构成的纯净物,属于化合物,而且含有钠元素,故均为钠的化合物,故③正确;
④Na2O2、Na2O、NaOH由钠元素和氧元素组成,属于钠的含氧化合物,NaCl不含氧元素,不是钠的含氧化合物,故④错误;
分类标准正确的是②③.
故选B.
点评 本题既考查了物质的分类,又考查了化合物的性质,找出它们的共同点是解题的关键,题目较简单.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
6.下列说法正确的是( )
| A. | 46g乙醇中含极性键数目为8NA | |
| B. | 2H2S+SO2=3S↓+2H2O中消耗1mol还原剂时转移电子数为4NA | |
| C. | 向1L1mol•L-1CH3COOH溶液中加入足量的铁粉充分反应,产生的氢分子数为0.5NA | |
| D. | 在6CO2+12H218O=C6H12O6+618O2+6H2O中,每产生13.44L氧气(标准状况),净减水分子数为1.2NA |
11.下列物质具有同分异构体数目最多的是( )
| A. | CH2Cl2 | B. | C4H9Cl | C. | C4H10 | D. | C3H6 |
8.下列说法正确的是( )
| A. | 次氯酸的结构式:H-Cl-O | |
| B. | 在BF3、PCl5中各元素的最外层都满足8电子稳定结构 | |
| C. | 溴化钙的电子式为:Ca2+[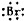 ]${\;}_{2}^{-}$ ]${\;}_{2}^{-}$ | |
| D. | 1molNa2O2中含有3NA个离子(NA表示阿伏加德罗常数) |
5.关于Na2CO3、NaHCO3两种盐的描述错误的是( )
| A. | 可以用加热的方法除去Na2CO3固体中的少量NaHCO3固体 | |
| B. | 可以用澄清石灰水鉴别Na2CO3和NaHCO3两种溶液 | |
| C. | 可以用通CO2气体的方法除去NaHCO3溶液中的Na2CO3 | |
| D. | 饱和Na2CO3溶液中通入CO2气体溶液会出现浑浊 |
9.某植物组织中含成分M,其结构如图所示.下列说法不正确的是( )


| A. | M分子中所有碳原子可能处在同一个平面上 | |
| B. | 1molM与浓溴水反应时最多消耗2molBr2 | |
| C. | M可以发生加成、加聚、氧化、还原、消去等反应 | |
| D. | M可以与Na、NaOH溶液、Na2CO3溶液反应 |
10.短周期元素 X、Y、Z、W、Q 在周期表中相对位置如图所示,已知 X 元素是地壳中含量最高的元素,下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | Y 的非金属性比Q强,所以HnY的酸性比HnQ强 | |
| B. | ZX2、WX2的熔沸点、硬度相差很大,这是由于它们的化学键类型不同造成的 | |
| C. | W、Q、Y 元素的原子半径及其简单离子半径依次减小 | |
| D. | 将足量的 X 单质通入 W 的氢化物的水溶液,能得到 W 的低价氧化物 |
 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: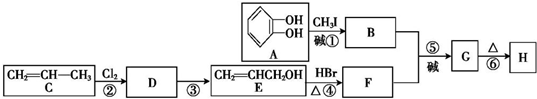
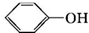 +RX$\stackrel{碱}{→}$
+RX$\stackrel{碱}{→}$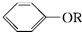 +HX(X代表卤素原子);
+HX(X代表卤素原子);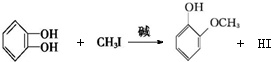 .
.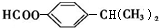 .
.