题目内容
9.自来水可以用氯气消毒,下列哪些药品不能用氯气消毒的自来水配制的是( )| A. | Na2SO4 | B. | NaCl | C. | AgNO3 | D. | AlCl3 |
分析 自来水中,氯气与水发生:Cl2+H2O?HClO+HCl,溶液中含有Cl2、HClO、H2O等分子,含有H+、ClO-、Cl-等离子,结合对应粒子的性质解答该题.
解答 解:A.氯水中的微粒均不与硫酸钠反应,可配制硫酸钠溶液,故A不选;
B.氯水中的微粒均不与NaCl反应,可配制NaCl溶液,故B不选;
C.氯水中含有Cl-,加入硝酸银生成氯化银沉淀,不能用于配制AgNO3溶液,故C选;
D.氯水中的微粒均不与AlCl3反应,可配制AlCl3溶液,故D不选.
故选C.
点评 本题考查氯气的性质,侧重于氯水的成分与性质的考查,为高考高频考点,很好地考查学生的科学素养,能提高学生学习的积极性,难度不大,注意相关基础知识的积累,本题中要注意氯水的成分和性质.

练习册系列答案
相关题目
20.测定结晶水合物中结晶水含量时,不需要的仪器是( )
| A. | 玻璃棒 | B. | 干燥器 | C. | 坩埚钳 | D. | 烧杯 |
17.下列事故处理不正确的是( )
| A. | 家用电器起火,常用液态CO2灭火,一般不用液态四氯化碳 | |
| B. | 将一氧化碳中毒者移到通风处抢救 | |
| C. | 眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉眼睛 | |
| D. | 实验后,剩余的药品不能随便丢弃(或浪费),应放回原瓶 |
4.有一学生欲配制下列无色透明溶液,其中可能实现的是( )
| A. | K+、Na+、MnO4-、SO42- | B. | Fe3+、Na+、HCO3-、Cl- | ||
| C. | K+、Cu2+、S2-、SO42- | D. | Na+、K+、OH-、AlO2- |
14.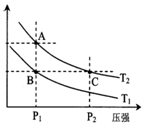 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的熵变△S<0 ( 填:“<,>,=”).该反应在低温(填:高温或低温)条件下能自发进行.
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
1.下列物质的保存方法正确的是( )
| A. | 少量白磷保存在冷水中 | B. | 氢氧化钠固体敞口放在空气中 | ||
| C. | 生石灰露置于空气中 | D. | 浓盐酸盛放在敞口玻璃瓶中 |
19.下列实验操作中,正确的是( )
| A. | 向试管中滴加试剂时,将滴管下端紧靠试管内壁 | |
| B. | 不能用燃着的酒精灯去点燃另一酒精灯 | |
| C. | 使用试纸检验溶液的性质时,将试纸浸入溶液中 | |
| D. | 加完药品后应将滴管洗净后再放回原瓶 |